Archiv für die Kategorie „Therapien“
Bauchspeicheldrüsenkrebs: Gemeinsamer Bundesausschuss G-BA bestätigt Wirksamkeit des Hochintensiven fokussierten Ultraschall (HIFU)
Die Fünf-Jahres-Überlebensrate bei Bauchspeicheldrüsenkrebs beträgt etwa sieben bis acht Prozent. In den meisten Fällen kann der Patient nur noch palliativ behandelt werden. „Bei etwa 80 Prozent der Betroffenen ist die Lebensqualität durch den Tumorschmerz deutlich bis massiv eingeschränkt”, betont Professor Dr. med. Holger Strunk, Oberarzt der Radiologischen Universitätsklinik Bonn. „Im Verlauf der Erkrankung werden diese Schmerzen häufig sogar therapieresistent. Den Patienten hilft dann keine Schmerzmedikation mehr.” Untersuchungen aus Deutschland und dem ostasiatischen Raum zeigen, dass der Einsatz von HIFU in etwa 80 Prozent der Fälle zur Schmerzlinderung bei den Betroffenen führt. „Wir begrüßen daher die G-BA-Entscheidung, dass HIFU bei diesen Patienten eingesetzt werden kann“, so Strunk.
Auch das Tumorvolumen kann durch diese Behandlung bei etwa zwei Drittel der Patienten signifikant verkleinert werden. Experten vermuten, dass HIFU nicht nur einen symptomatischen Nutzen hat, sondern dass diese Methode möglicherweise auch das Überleben positiv beeinflusst. „Hierzu fehlen uns noch weitere klinische Untersuchungen, doch erste Ergebnisse zeigen, dass HIFU ein großes Potential in der Tumorentfernung haben könnte”, erklärt Strunk. Diese Ultraschall-Technik bietet Anwendern und Patienten viele Vorteile: Die Behandlung erfolgt wenig invasiv – und ruft dadurch in der Regel nur geringe Nebenwirkungen hervor. Im Gegensatz zum diagnostischen Ultraschall bündelt der Ultraschallkopf beim HIFU die hochenergetischen Schallwellen wie bei einem Hohlspiegel in einem Brennpunkt innerhalb des menschlichen Körpers. Durch die Absorption der Ultraschallwellen entsteht Wärme, die das Gewebe im Fokus des HIFU auf bis zu 80 Grad erhitzt. Bei diesen Temperaturen gerinnt das Eiweiß und die Zellen des Tumors sterben ab.
„Ein weiterer großer Vorteil ist, dass sehr präzise gearbeitet werden kann und auch Tumore in der Nähe von Blutgefäßen behandelt werden können“, ergänzt Strunk. „Da keine Nadeln, Sonden oder ähnliches eingebracht werden müssen, besteht zudem keine Gefahr einer Blutung oder der Tumorzellverschleppung, wie sie bei anderen Verfahren durch den Stichkanal vorkommen kann.“ Der G-BA hat auch überprüft, ob Studien vorliegen, die den Stellenwert des HIFU bei anderen Erkrankungen belegen. Da dies aber ein relativ neues Verfahren ist, gibt es jedoch bisher nur zu wenigen Krankheitsbildern Studien, wie eben zum Pankreaskarzinom, dem Leberzellkarzinom und dem Gebärmuttermyom. Nichtsdestotrotz könnten zukünftige Untersuchungen auch hier weitere Indikationen aufzeigen. Auf völliges Unverständnis seitens der DEGUM stößt daher die Ablehnung des G-BA, den Stellenwert des HIFU bei anderen Indikationen wie Leber-, Knochenmark- und Knochentumoren oder der Endometriose, einer gutartigen Wucherung von Gewebe der Gebärmutterschleimhaut, durch Studien zu evaluieren.
„Mag ja sein, dass zukünftige Studien aufzeigen, dass es hier für den HIFU keinen Stellenwert gibt. Doch viele Patienten mit diesen Erkrankungen profitieren nachweislich von einem Einsatz des HIFU. Gerade bei der palliativen Behandlung von Knochenmetastasen am peripheren Skelett könnte HIFU zunehmend an Bedeutung gewonnen”, erklärt Strunk. „Nur weil derzeit keine deutschen Studien vorliegen, kann man doch nicht a priori weitere Studien ausschließen. Was ist das für ein Verständnis von Wissenschaft. Hier müssten unbedingt weitere klinische Studien zur Untersuchung des langfristigen Nutzens dieser Methode erfolgen”, so der DEGUM-Experte.
Litera:turhinweise:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5376281/
Quelle: Deutsche Gesellschaft für Ultraschall in der Medizin (DEGUM) - www.degum.de
Bewegungstherapie hocheffektiv
Neue Erkenntnisse zu Fatigue und Polyneuropathie beim 33. Deutschen Krebskongress 2018 in Berlin vorgestellt.
Viele Krebspatienten leiden unter den Nebenwirkungen ihrer Therapie. Dazu gehören etwa Erschöpfung, auch Fatigue-Syndrom genannt, oder Polyneuropathie, eine Schädigung der Nerven. Gezieltes bewegungstherapeutisches Training hilft, die zum Teil starken Einschränkungen zu reduzieren und die Lebensqualität der Betroffenen zu steigern. Aktuelle Studienergebnisse – unter anderem eine Meta -Analyse aus den USA – konnten nun belegen: Körperliche Aktivität vermindert die Beschwerden erfolgreicher als eine medizinische oder eine psychologische Therapie.
„Bewegung ist das geeignetste ‚Medikament‘ zur Reduzierung des Fatigue-Syndroms“, berichtete PD Dr. Freerk Baumann, Leiter der Arbeitsgruppe Onkologische Bewegungsmedizin am CIO Köln/Bonn. Doch nicht nur bei der Behandlung des Fatigue-Syndroms gibt es neue Erkenntnisse. „Auch bei der Chemotherapie-induzierten Polyneuropathie (CIPN) zeigen Studien, dass Bewegungstherapie hilft. Für die Polyneuropathie gibt es keine andere Behandlungsmethode, deren nachhaltige Wirkung bewiesen werden konnte“, so Baumann weiter. „Sensomotorisches Training und womöglich auch Vibrationstraining erzielen die besten Effekte bei der Therapie von Nervenschäden, wie eingeschränktes Tastgefühl an den Händen sowie Kribbeln und Schmerzen an Händen und Füßen.“ Dieser Ansatz wird derzeit in einer gemeinsamen Studie der Deutschen Sporthochschule Köln und der Uniklinik Köln weiter verfolgt. Erste Forschungsergebnisse unterstützen die Annahme, dass spezielles Bewegungstraining eine hemmende Wirkung auf die CIPN haben könnte.
Trotz der Erfolge, die mit einer gezielten Bewegungstherapie erreicht werden können, ist es jedoch schwierig, entsprechende Versorgungsstrukturen für alle Patienten zu schaffen. „Ein therapeutisches Training während der medizinischen Krebstherapie muss individuell auf die Patienten angepasst werden. Hierzu bedarf es speziell ausgebildeter Sport- und Physiotherapeuten, von denen es zurzeit noch nicht genügend gibt“, erklärte der Direktor des Centrums für integrierte Onkologie (CIO) Köln/Bonn, Professor Dr. Michael Hallek. „Darüber hinaus bestehen in den Onkologischen Zentren auch räumliche und finanzielle Engpässe, um hochwertige Trainingsgeräte anzuschaffen.“ Erschwerend käme hinzu, dass die Sporttherapie im Gegensatz zur Physiotherapie nicht im Heilmittelkatalog aufgeführt ist , obwohl die positiven Effekte durch Sporttherapie bereits sehr gut wissenschaftlich belegt seien.
„Hier ist die Gesundheitspolitik gefordert, dies schnellstens zu ändern“, unterstrich PD Dr. Baumann. „Denn, würde die Sporttherapie in den Heilmittelkatalog aufgenommen, so wäre es für die Krebszentren deutlich einfacher, entsprechende bewegungstherapeutische Strukturen aufzubauen.“ Um umfassende Informationen über die Versorgungsstrukturen zur Bewegungstherapie in Deutschland zu erhalten und Erkenntnisse darüber zu gewinnen, inwieweit Krebspatienten die Möglichkeiten der Sporttherapie überhaupt vermittelt werden, hat die Deutsche Krebshilfe eine bundesweite Umfrage bei über 700 Krebszentren durchgeführt. „Die Ergebnisse dieser Befragung werden in Kürze vorliegen, doch schon jetzt zeichnet sich dringender Handlungsbedarf ab“, erklärte Gerd Nettekoven, Vorstandsvorsitzender der Deutschen Krebshilfe.
„Das Thema körperliche Aktivität in der Krebstherapie hat für die Deutsche Krebshilfe einen hohen Stellenwert. Wir halten es für wichtig, die Forschung auf diesem Gebiet voranzutreiben, um weitere wissenschaftliche Erkenntnisse zu erhalten. Wir wollen aber auch Krebspatienten und Ärzte umfassend über die positiven Effekte der Bewegungstherapie informieren.
“ Dies gelte zudem nicht nur für die Zeit während der Therapie, sondern auch für die Zeit danach, denn auch in der Krebsnachsorge seien Sport und Bewegung wichtig für das Wohlbefinden der Betroffenen. Um das Thema Bewegung stärker und mit Nachhaltigkeit sowohl in der Therapie als auch in der Krebsnachsorge zu verankern, haben die Deutsche Krebshilfe, der Deutsche Olympische Sportbund und die Deutsche Sporthochschule Köln im Jahr 2014 die Initiative „Bewegung gegen Krebs“ gestartet.
Unterstützt werden sie dabei von Heiko Herrlich, ehemaliger Fußballprofi und heute Bundesligatrainer sowie Antje Möldner-Schmidt, Europameisterin im 3.000-Meter-Hindernislauf. Herrlich und Möldner-Schmidt wissen als ehemalige Patienten um die zentrale Bedeutung von Sport und Bewegung während und nach der Krebstherapie. „Für mich brach eine Welt zusammen, als ich mit der Diagnose Krebs konfrontiert wurde“, berichtete Möldner-Schmidt in Berlin. „Doch Sport und Bewegung haben mir sehr geholfen, die schwere Zeit durchzustehen und viele Hürden zu überwinden.“ Die Leichtathletin erkrankte im Januar 2010 an Morbus Hodgkin. Bereits zehn Monate nach der Diagnose nahm sie das Training wieder auf und wurde im Jahr 2014 Europameisterin.
Quelle: Presseinformation 33. Deutscher Krebskongress 2018, Pressestelle Deutsche Krebsgesellschaft und Pressestelle Stiftung Deutsche Krebshilfe e.V.
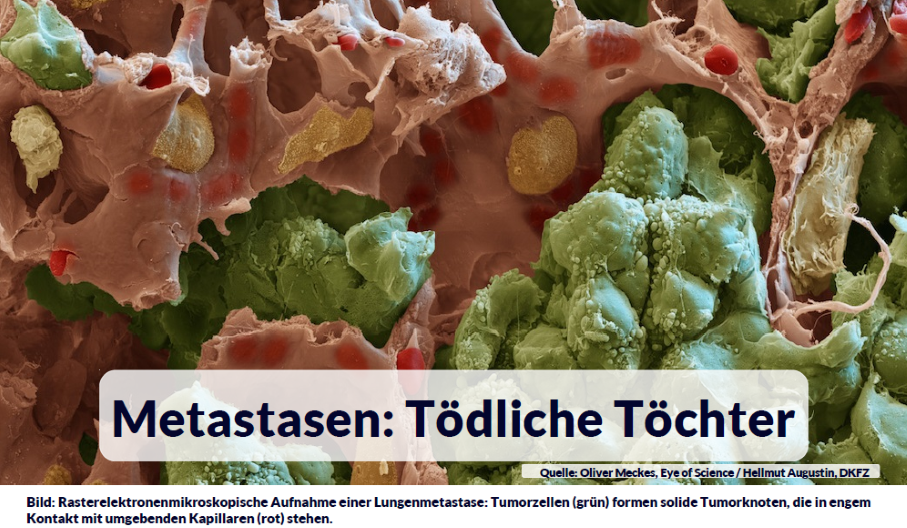
Metastasen: die tödlichen Töchter
Cirka 90 Prozent aller Krebstodesfälle gehen auf das Konto von Metastasen, wie Mediziner die Absiedlungen bösartiger Tumoren nennen. Hat sich der Krebs erst im Körper verbreitet, ist er in der Regel nicht mehr heilbar. Zum Weltkrebstag 2018 informierten Experten aus dem Deutschen Krebsforschungszentrum, wie es zu dieser Ausbreitung kommt: Tumorzellen zweckentfremden Blutbahnen, sabotieren ihre Umgebung und tarnen sich als “Schläfer”. Aber die Wissenschaftler haben Ideen, wie sich dieser lebensbedrohliche Prozess möglicherweise aufhalten lässt. Was macht Krebserkrankungen so gefährlich? 90 Prozent aller Krebstodesfälle gehen auf das Konto von Tumorabsiedlungen, schätzt die Weltgesundheitsorganisation WHO. Krebszellen, die sich vom Primärtumor absondern, gelangen in entfernte Körperregionen und wachsen dort zu Tochtergeschwülsten, Metastasen, heran. “Während sich viele Primärtumoren vor allem in frühen Stadien heute gut behandeln lassen, sind Metastasen die eigentliche und letztlich tödliche Gefahr”, erklärt Susanne Weg-Remers, die Leiterin des Krebsinformationsdienstes des Deutschen Krebsforschungszentrums (DKFZ). “Leider kommt es immer wieder vor, dass ein Tumor nach zunächst erfolgreicher Behandlung wiederkehrt. Wenn dann der Krebs bereits gestreut hat, sinken die Erfolgsaussichten einer Therapie rapide. Neue Medikamente, die das Rückfallrisiko senken können, sind daher ein zentrales Anliegen der Krebsforschung.” Forscher schätzen, dass sich von einem Tumor in der Größe eines Kubikzentimeters täglich etwa eine Million Zellen ablösen können – aber nur ein verschwindend kleiner Prozentsatz davon wächst tatsächlich zu einer Tochtergeschwulst heran. “Die Metastasierung ist im Grunde genommen extrem ineffizient: Es müssen sehr viele Voraussetzungen zusammenkommen, dass es dem Tumor gelingt, sich auszubreiten. Trotz der immensen medizinischen Bedeutung der Metastasierung ist dieser Prozess leider noch sehr wenig verstanden”, sagt Hellmut Augustin vom DKFZ und von der Medizinischen Fakultät Mannheim der Universität Heidelberg. Heute ist unbestritten, dass sich Krebszellen – anders als früher vermutet – auch schon von kleinsten Tumoren ablösen können. Um sich nun im Körper zu verbreiten, ist ein Transportsystem erforderlich – und das organisiert sich der Tumor selbst: Von einem Durchmesser von etwa einem Millimeter an ist jede Krebsgeschwulst auf die Versorgung durch Blut- oder Lymphgefäße angewiesen. Die lockt sie aktiv mit Wachstumsfaktoren herbei – und zweckentfremdet sie als Fernstraßen, um Lunge, Leber oder das Gehirn zu erreichen. Tumorzellen und Blutgefäße: eine intime Beziehung Die Reise über die Blutbahnen ist für eine Krebszelle beschwerlich: Sie muss sich zunächst durch die Zellen der Gefäßwand zwängen. In der Blutbahn selbst ist die starke Strömung eine immense Herausforderung. Um das Gefäßinnere wieder zu verlassen, braucht die Krebszelle geeignete Proteine zum Andocken und Überwinden der Gefäßbarriere. “Das ist ein extrem aktiver Prozess, der auf zahlreichen Wechselwirkungen zwischen der Krebszelle und den Gefäßwandzellen beruht”, sagt Andreas Fischer vom DKFZ. Der Gefäßexperte, der auch an der Medizinischen Fakultät Mannheim der Universität Heidelberg forscht, erkannte vor kurzem, dass Krebszellen die Blutgefäße für ihre eigenen Zwecke umprogrammieren: Sie veranlassen die Gefäßwandzellen, ihnen leichter Durchlass zu gewähren. Zugleich bilden die Gefäßwandzellen bestimmte Proteine aus, an denen sich die Krebszelle wie mit einem Druckknopf verankern und die Blutbahn wieder verlassen kann. Fischers Team konnte die molekularen Schalter, die an dieser Sabotage beteiligt sind, identifizieren und teilweise mit Antikörpern blockieren: Daraufhin entwickelten krebskranke Mäuse weniger Lungenmetastasen. Wegen der immensen Bedeutung der Blutgefäße für Wachstum und Ausbreitung der Tumoren ist die Gefäßneubildung seit Jahrzehnten schon im Visier der Krebsforscher. Das erste Medikament, das diesen Vorgang blockiert, kam bereits 2005 auf den Markt – erzielte aber nur mäßige klinische Erfolge. Hellmut Augustin versucht daher, auf andere Weise zu verhindern, dass sich der Tumor mit neuen Adern versorgt. Dazu erforscht er systematisch die Signalmoleküle der Gefäßwandzellen – und entdeckte kürzlich den Rezeptor Tie1 als mögliches neues Therapieziel: Krebskranke Mäuse, in deren Gefäßwandzellen Tie1 genetisch ausgeschaltet war, entwickelten deutlich langsamer und deutlich weniger Metastasen – im Gegensatz zu ihren genetisch normalen Artgenossen. “Sicherlich müssen mehrere Schlüsselmoleküle zugleich blockiert werden, um die Gefäßneubildung wirklich effizient zu unterdrücken”, so der DKFZ-Forscher. “Ein Wirkstoff, der den Rezeptor Tie1 inaktiviert, ließe sich sinnvoll mit anderen antiangiogenen Medikamenten kombinieren.” Fruchtbarer Boden für Metastasen Metastasen treten nicht nach dem Zufallsprinzip im Körper auf, sondern – je nach Tumorart – bevorzugt in bestimmten Organen. So siedelt Prostatakrebs besonders häufig in die Wirbelsäule ab, Melanome in das Gehirn. Woran das liegt, ist nur teilweise bekannt. Allein an der Blutmenge, die ein Organ durchströmt, kann es nicht liegen, sonst müsste es beispielsweise viel mehr Metastasen in den Nieren geben – was aber tatsächlich sehr selten vorkommt. Bereits 1889 veröffentlichte der britische Chirurg Stephen Paget dazu eine berühmte Theorie: “Seed and Soil”, zu Deutsch etwa Saatkorn und Boden, müssten bei der Metastasierung zusammenwirken, so der Forscher. Bestimmte Gewebe böten bestimmten Krebszellen einen “fruchtbaren Boden”, beispielsweise in Form von Wachstumsfaktoren oder Molekülen, an die Krebszellen andocken und sich festsetzten können. “Schläfer” im Gehirn ausschalten Besonders viele Rätsel gibt die Entstehung von Hirnmetastasen auf. Insbesondere Melanome, Brust- und Lungenkrebs siedeln sich im Gehirn an: “Obwohl es für Krebszellen gar nicht so einfach ist, dort hinzukommen”, sagt Frank Winkler, der am DKFZ und am Universitätsklinikum Heidelberg erforscht, wie Hirnmetastasen entstehen. Winkler hatte im Gehirn von Mäusen das Verhalten einzelner Tumorzellen beobachtet und dabei ein typisches Verhaltensmuster festgestellt: Nach dem Austritt aus der Blutbahn heftet sich die Krebszelle an die Außenseite feiner Kapillargefäße und schart dort bestimmte Gehirnzellen um sich. In dieser “Gefäß-Nische” nehmen Hirnmetastasen grundsätzlich ihren Anfang. Die Frage ist nur, wann: Manchmal bleibt die Krebszelle einfach in ihrer Nische liegen, ohne zu wachsen. “Es ist ein großes medizinisches Problem, dass Metastasen oft erst viele Jahre nach einer scheinbar erfolgreichen Krebsbehandlung auftreten. “Wir wollen unbedingt herausfinden, wie diese “Schläfer” es schaffen, zu einer lebensgefährlichen Hirnmetastase heranzuwachsen”, so der Neurologe. Damit befasst sich das von der Deutschen Krebshilfe finanzierte Verbundprojekt “Präventive Strategien gegen Hirntumoren”, das Winkler leitet. “Wir haben bereits wichtige Prozesse der Gehirnmetastasierung aufgeschlüsselt und nehmen gezielt solche Interaktionen zwischen Tumorzelle und Gehirn ins Visier, die wir mit heute schon verfügbaren Medikamenten beeinflussen können.” In spätestens drei Jahren wollen die Forscher genug Erkenntnisse gesammelt haben, um eine klinische Studie zu starten. Das Ziel ist, mit dem aussichtsreichsten Wirkstoff zukünftige Gehirnmetastasen zu verhindern. “Metastasen sind auch deswegen schwer zu behandeln, weil sie sich häufig stark von den Krebszellen des Ursprungstumors unterscheiden”, erklärt Susanne Weg-Remers. “Neue Medikamente, die verhindern, dass Tumoren sich überhaupt auf diese Weise ausbreiten, könnten die Krebstherapie bedeutend verbessern. Bis dahin ist es umso wichtiger, dass Krebs früh erkannt wird, bevor der Tumor gestreut hat. Rechtzeitig behandelt, gibt es heute bei vielen Krebsarten eine gute Chance auf Heilung.”
Quelle: DKFZ -Deutsches Krebsforschungszentrum, Heidelberg Der Krebsinformationsdienst des Deutschen Krebsforschungszentrums: Telefon: 0800 420 30 40 (kostenfrei, täglich von 8.00 – 20.00) E-Mail: krebsinformationsdienst@dkfz.de www.krebsinformationsdienst.deAML (Akute myeloische Leukämie) – Neues Medikament verlängert deutlich Überlebenszeit
Ein internationales Konsortium hat unter deutscher Beteiligung – unter anderem mit Wissenschaftlern von der Medizinischen Hochschule Hannover (MHH) – erfolgreich eine neue Therapie zur Behandlung der Akuten myeloischen Leukämie (AML) entwickelt. Mit dem Einsatz des Medikaments Midostaurin zusätzlich zur standardgemäßen Behandlung kann das durchschnittliche Gesamtüberleben von AML-Patienten mit einer speziellen Genmutation – des FLT3-Gens – von 25,6 Monaten auf 74,7 Monate verlängert werden. Von der MHH sind Professor Dr. Arnold Ganser und Professor Dr. Jürgen Krauter (Chefarzt der Klinik f. Hämatologie und Onkologie am Klinikum Braunschweig) Koautoren. “Die Studie ist deshalb so wichtig, weil sie nach vielen Jahrzehnten erstmals wieder zu einer Neuzulassung eines Medikamentes für jüngere Patienten mit AML geführt hat”, sagt Professor Ganser, Direktor der Klinik für Hämatologie, Hämostaseologie, Onkologie und Stammzelltransplantation. Dieses Medikament wird für jeden dritten Patienten mit AML den Behandlungserfolg deutlich verbessern. Die Ergebnisse sind in der Online-Ausgabe der renommierten Fachzeitschrift New England Journal of Medicine veröffentlicht (June 23, 2017; DOI: 10.1056/NEJMoa1614359). Midostaurin ist kein Chemotherapeutikum, sondern gehört zur Gruppe der molekular wirkenden Medikamente, die gezielt genetische Veränderungen in den Tumorzellen ausnutzen. Es ist vom Bakterium Streptomyces staurosporeus abgeleitet, das die Teilung der leukämischen Zellen verhindert, indem es die Weiterleitung von Signalen, unter anderem des Wachstumsfaktors FLT3 aber auch anderer Kinasen, blockiert. Um Midostaurin einsetzen zu können, müssen die Leukämiezellen bestimmte Mutationen in einem ganz bestimmten Gen, dem FLT3-Gen, aufweisen. Dies wird vor Beginn der Therapie getestet. “Bei etwa einem Drittel der AML-Patienten lassen sich diese spezifischen FLT3-Mutationen nachweisen und gezielt für die Therapie ausnutzen”, erklärt Professor Ganser. “An der MHH besteht eines der weltweit acht Labore, in denen im Rahmen der Studie Patientenzellen auf diese genetischen Veränderungen geprüft wurden.” Dazu werden im Hämatologisch-molekulargenetischen Labor der MHH-Klinik von Professor Ganser unter der Leitung von Professor Dr. Michael Heuser und Privatdozentin Dr. Felicitas Thol die Tumorzellen auf eine Vielzahl von Mutationen (Veränderungen) getestet, um die jeweils beste Therapie zu identifizieren.
 Prof. Dr. Arnold Ganser (links) im Gespräch mit Privatdozentin Felicitas Thol und Prof. Dr. Michael Heuser
Prof. Dr. Arnold Ganser (links) im Gespräch mit Privatdozentin Felicitas Thol und Prof. Dr. Michael Heuser
Die Amerikanische Zulassungsbehörde FDA hat Ende April Midostaurin in Kombination mit der herkömmlichen Chemotherapie zur Behandlung der AML zugelassen, die Schweiz wenige Tage später. Die Zulassung für die übrigen europäischen Länder durch die EMA (European Medicines Agency) wird wohl noch in diesem Jahr erfolgen. “Für uns bedeutet es einen großen Erfolg in der klinischen Forschung zum Wohle der Patienten”, betont Professor Ganser.
Quelle: MHH Medizinische Hochschule Hannover vom 4. Juli 2017
Abstract der Studiendaten im “The NEW ENGLAND JOURNAL of MEDICINE” - http://www.nejm.org/doi/full/10.1056/NEJMoa1614359#t=abstractBrustkrebs: Höhere Dosis im Tumorgebiet bringt auch nach zwanzig Jahren bessere Tumorkontrolle für viele Patientinnen
Die Strahlentherapie nach einer brusterhaltenden Operation ist eine hocheffektive Behandlungsmethode. Eine Dosissteigerung – „Boost“ genannt – im ehemaligen Tumorbereich kann verhindern, dass es an der operierten Brust erneut zum Krebswachstum kommt. Dies bestätigt nun eine europäische Langzeitstudie, in der die Ergebnisse der Studienteilnehmerinnen 20 Jahren nach der Erkrankung ausgewertet wurden. Nach Einschätzung der Deutschen Gesellschaft für Radioonkologie (DEGRO) zeigt die Studie deutlich, dass viele Patientinnen von dieser höheren Dosis profitieren, insbesondere Frauen unter 50 und Frauen mit speziellen zusätzlichen histologischen Veränderungen, einem sogenannten DCIS.
Ein Brustkrebs im Frühstadium kann heute brusterhaltend operiert werden. „Zum Behandlungsstandard gehört heutzutage eine Bestrahlung, da es sonst zu einem Lokalrezidiv, also einem erneuten Burstkrebswachstum an der operierten Brust, kommen kann“, erläutert Professor Stephanie E. Combs von der Technischen Universität München.
Prof. Dr. Stephanie E. Combs, Direktorin der Klinik und Poliklinik für RadioOnkologie und Strahlentherapie am Universitätsklinikum der Technischen Universität München (TUM). Foto: DEGRO Deutsche Gesellschaft für Radioonkologie e.V.Um die optimale Dosis zu bestimmen, hat die European Organization for Research and Treatment of Cancer (EORTC) zwischen 1989 und 1996 eine Studie an 5.569 an Brustkrebs erkrankten Frauen durchgeführt. „Die Hälfte der Patientinnen erhielt damals neben der üblichen eine zusätzliche Bestrahlung der operierten Brust im Bereich des Tumorbettes die wir als Boost bezeichnen“, sagt die Pressesprecherin der DEGRO. Der Boost verlängere die Behandlungszeit zwar um knapp zwei Wochen, er könne aber ein Lokalrezidiv verhindern.
Die Teilnehmerinnen der EORTC-Studie werden seit dem Ende der Behandlung regelmäßig nachuntersucht, um herauszufinden, für welche Patientinnen der Boost den größten Nutzen bringt. Schon in den ersten Jahren zeigte sich, dass Frauen mit ungünstigen Gewebemerkmalen, sogenannten „high-grade“-Tumoren, den größten Nutzen haben. Dies konnte auch noch nach 20 Jahren bestätigt werden. Die Langzeitanalyse zeigt nochmals deutlich, dass prinzipiell alle Frauen von einer Dosisaufsättigung profitieren können. Der größte Vorteil zeigt sich für jüngere Patientinnen unter 50 Jahre. Sie erlitten nach einer Boost-Bestrahlung signifikant seltener ein Lokalrezidiv an der operierten Brust. Insgesamt jedoch profitieren alle Altersgruppen von einer Boostbestrahlung. Die zweite Gruppe sind Patientinnen, bei denen der Pathologe in der Nähe des invasiven Karzinoms die Krebsvorstufe DCIS gefunden hat. Bei duktalen Carcinoma in situ (DCIS) liegen in den Milchgängen der Brustdrüse veränderte Zellen vor, die aber noch am Ort verbleiben. „Die DCIS können noch keine Metastasen bilden“, sagt DEGRO-Präsident Professor Dr. med. Dr. rer. nat. Jürgen Debus. „Wenn DCIS-Nester in der Nähe des Primärtumors gefunden werden, ist es jedoch möglich, dass es später zu einem Lokalrezidiv kommt“, fügt Debus hinzu.
 Prof. Dr. Jürgen Debus
DEGRO Präsident und
Ärztliche Direktor der Klinik für RadioOnkologie
und Strahlentherapie (Czerny-Klinik)
am Universitätsklinikum Heidelberg
Foto: DEGRO Deutsche Gesellschaft für Radioonkologie e.V.
Prof. Dr. Jürgen Debus
DEGRO Präsident und
Ärztliche Direktor der Klinik für RadioOnkologie
und Strahlentherapie (Czerny-Klinik)
am Universitätsklinikum Heidelberg
Foto: DEGRO Deutsche Gesellschaft für Radioonkologie e.V.
Die EORTC-Studie liefert den Beweis, dass der Boost für die beiden Patientinnengruppen von erheblichem Vorteil ist: Bei jüngeren Frauen mit DCIS in der Nähe des Primärtumors verringerte die Boost-Bestrahlung die Rate von Lokalrezidiven an der operierten Brust von 31 auf 15 Prozent, halbiert sie also. Die Verlaufskurven lassen sogar vermuten, dass die Vorteile sich nach Ablauf von 20 Jahren noch weiter verstärken könnten. „Die EORTC-Studie zeigt, wie notwendig eine lange Nachsorge ist. Diese Langzeitdaten sind gerade für die jungen Patientinnen sehr wichtig. Prinzipiell ist ein Boost jedoch bei allen Frauen sinnvoll“, sagt Debus.
Literatur:
Vrieling C et al. Prognostic Factors for Local Control in Breast Cancer After Long-term Follow-up in the EORTC Boost vs No Boost Trial: A Randomized Clinical Trial. JAMA Oncology 2017; 3: 42-48. Abstract
Quelle: DEGRO Deutsche Gesellschaft für Radioonkologie e.V. – Internet: www.degro.org
Was den Patienten gut tut – Integrative Onkologie
„Die integrative Onkologie steht auf dem Boden der wissenschaftlichen, fundierten Medizin und stellt den Patienten mit seiner Perspektive und seinen Lebenszielen in den Vordergrund‘‘, betont Prof. Dr. Jutta Hübner. Das Ziel ihres Faches sieht Professorin Hübner in der auf die Bedürfnisse des Patienten abgestimmten Therapie als eine Kombination aus schulmedizinischen und sinnvollen ergänzenden Behandlungsmöglichkeiten.
 Prof. Dr. Jutta Hübner, Stiftungsprofessur für integrative Onkologie, Universitätsklinikum Jena
Prof. Dr. Jutta Hübner, Stiftungsprofessur für integrative Onkologie, Universitätsklinikum Jena
Über die Hälfte der Krebspatienten versucht neben der vom Arzt verordneten Strahlen- oder Chemotherapie auch pflanzliche Stoffe, Nahrungsergänzung oder Naturheilmittel, die in bunten Zeitschriften angepriesen oder in online-Erfahrungsberichten positiv bewertet werden. Bei den Brustkrebspatientinnen liegt dieser Anteil noch weit höher. „Für die Wirksamkeit der ergänzenden Mittel oder Methoden gibt es nur minimale Nachweise, und oft erfährt der behandelnde Arzt nichts von dieser Selbstbehandlung“, nennt Jutta Hübner gleich zwei zentrale Probleme dabei. Die Internistin hat seit diesem Jahr die Professur für Integrative Onkologie am Universitätsklinikum Jena inne, die die
Deutsche Krebshilfe als Stiftungsprofessur an der Klinik für Innere Medizin II eingerichtet hat und die direkt an das Universitätstumorzentrum angebunden ist.
Vor allem in der Onkologie, aber auch bei anderen chronischen vielschichtigen Krankheitsbildern ist der Bedarf an ergänzenden oder alternativen Behandlungsmöglichkeiten sehr groß – vor allem, wenn man körperliche Aktivität, Psychoonkologie oder Selbsthilfegruppenarbeit mit dazu zählt. „Und die komplementäre Medizin hat durchaus das Potential, den Patienten zu helfen‘‘, so Jutta Hübner. Als Beispiele zählt sie Ingwer gegen die Übelkeit bei Chemotherapie auf oder Yoga und leichten Sport zur Abmilderung des Erschöpfungszustandes Fatigue. Neben qualitativ hochwertigen Studien fehlt es vor allem an fundierten Informationen über komplementäre Behandlungsmöglichkeiten, sowohl bei den
Patienten, als auch bei den Ärzten.
Hier will Professorin Jutta Hübner, die zuvor eine Informationsdatenbank der Deutschen Krebsgesellschaft und der Deutschen Krebshilfe aufgebaut hat, mit einem niederschwelligen Angebot ansetzen. In regelmäßigen Vorträgen für Krebspatienten, Angehörige und Interessenten wird sie am Uniklinikum Jena über die Möglichkeiten und Risiken komplementärer Medizin informieren. In der Patientenversorgung führt sie die Arbeit der Ambulanz für Naturheilkunde und Integrative Onkologie an der Klinik für Innere Medizin II des Uniklinikums fort und plant, einen Konsildienst für stationäre Patienten des Klinikums zu etablieren.
Neben der Versorgungsforschung zum Informationsbedarf von Patienten zur komplementären und alternativen Medizin und zur Arzt-Patienten-Kommunikation, die gerade in der Onkologie auch zentrale medizinethische und medizinökomische Aspekte berührt, liegt der wissenschaftliche Schwerpunkt von Jutta Hübner in der evidenzbasierten Untersuchung komplementärer Medizin. „Gute Studienkonzepte in der Komplementärmedizin sind sehr aufwendig, dazu sind Netzwerke notwendig und eine Forschungskultur, zu deren Etablierung ich beitragen möchte‘‘, so Jutta Hübner.
Nach dem Medizinstudium in Düsseldorf absolvierte Jutta Hübner die Facharztausbildung in Innerer Medizin in Remscheid. Sie spezialisierte sich für die Hämatologie und internistische Onkologie und erwarb Zusatzqualifikationen in der Chirotherapie, Palliativmedizin, Naturheilkunde und Psychoonkologie. Nach klinischen Leitungspositionen in Bad Soden-Salmünster, Kassel und am Universitätsklinikum Frankfurt/Main arbeitete sie bei der Deutschen Krebsgesellschaft und habilitierte sich an der Friedrich-Schiller-Universität Jena zum Stand und der Zukunftsperspektive der integrativen Onkologie.
Quelle: Universitätsklinikum Jena
Nebenwirkungsmanagement: Neue Behandlungsleitlinie zu Begleittherapien (Supportivtherapie)
Patienten von heute profitieren mit einem hohen Maß an Lebensqualität durch sogenannte begleitende beziehungsweise unterstützende Therapien die auch Supportivtherapien genannt werden. Waren beispielsweise noch vor wenigen Jahren Übelkeit und Erbrechen im Zusammenhang mit einer Chemotherapie eine der am häufigsten von Patienten gefürchteten Nebenwirkungen, so ist dies inzwischen für Patienten durch eine entsprechende und äußerst effiziente Begleittherapie nur noch selten ein Thema. Doch wirksame Krebstherapien bringen vielfältige Nebenwirkungen mit sich. Eine neue Behandlungsleitlinie versucht nun, Behandlern eine einheitliche Übersicht zu bieten.
Die mit 558 Seiten überaus umfangreiche und lesenswerte Behandlungsleitlinie ist kostenfrei unter folgender Webseite abrufbar: http://leitlinienprogramm-onkologie.de/Supportive-Therapie.95.0.html„Unterstützende Maßnahmen machen die Krebsbehandlung verträglicher, verbessern die Lebensqualität der Patienten und stellen sicher, dass eine wirksame Tumortherapie fortgeführt werden kann. Supportive Therapien sind selbstverständliche Bausteine jeglicher Behandlung onkologischer Erkrankungen und ihr sachgerechter Einsatz ist ein Qualitätsmerkmal für eine gute Behandlung – das gilt für Patienten aller Altersgruppen von der Diagnosestellung und der Erstbehandlung bis hin zur palliativen Versorgung“, kommentiert Prof. Dr. Karin Jordan, Onkologin an der Universität Halle und Koordinatorin der neuen Leitlinie. „Die Leitlinie unterstützt Ärzte und andere Berufsgruppen bei der Entscheidung über die optimale Unterstützung mit formal konsentierten, klar verständlichen und nachvollziehbaren Empfehlungen.“ Auf der Grundlage der vorliegenden Leitlinie wird derzeit eine Patientenleitlinie erarbeitet.
Die Arbeitsgemeinschaft Supportive Maßnahmen in der Onkologie, Rehabilitation und Sozialmedizin (ASORS) in der Deutschen Krebsgesellschaft, die Deutsche Gesellschaft für Hämatologie und Onkologie (DGHO) und die Deutsche Gesellschaft für Radioonkologie (DEGRO) möchten mit der Erarbeitung der Leitlinienempfehlungen eine bundesweite Basis für eine Standardisierung wichtiger Themen bei der fachübergreifenden Behandlung der Komplikationen der Krebstherapie und Krebserkrankung legen. Die S3-Leitlinie behandelt auf 558 Seiten zehn Themen aus dem Bereich der supportiven Krebstherapie:
• Anämie (Blutarmut) aufgrund der Tumortherapie
• Neutropenie (Mangel an weißen Blutkörperchen) aufgrund der Tumortherapie
• Übelkeit und Erbrechen aufgrund der Tumortherapie
• Therapiebedingte Durchfälle
• Entzündung der Mundschleimhaut aufgrund der Tumortherapie
• Therapiebedingte Hautproblemen
• Periphere Nervenschädigungen aufgrund der Tumortherapie (Polyneuropathie)
• skelettbezogene Komplikationen (Knochenmetastasen, Knochenbrüche,…)
• Gewebeschädigungen als Komplikation bei einer intravenösen Infusion
• Begleittherapien (supportive Maßnahmen) der Strahlentherapie
Quelle:
Pressestelle der Deutschen Krebsgesellschaft e.V.
Pressestelle der Deutschen Gesellschaft für Hämatologie und Medizinische Onkologie e.V.
Pressestelle der Deutschen Gesellschaft für Radioonkologie e.V.
….und fragen Sie Ihren Arzt oder Apotheker! – Was kann und darf man als Krebspatient von einer Apotheke erwarten?
Mit anklicken des Bildes startet das Video auf unserem YouTube Kanal.
Apotheker Dr. Christian Fehske von der Internationalen Rathaus Apotheke in Hagen zeigt in einem Gespräch am Rande des Krebsinformationstages auf, was Krebspatienten von einer Zytostatika herstellenden Apotheke erwarten dürfen und kommentiert die derzeitigen Entwicklungen in der Onkologie.
Neue innovative Medikamente vom Gemeinsamen Bundesausschuss mehrfach mit “Zusatznutzen nicht belegt” bewertet – Medizinische Fachgesellschaften sehr besorgt über diese Entwicklung
Ob beim Lungenkrebs, chronischen lymphatischen Leukämie (CLL) oder Dickdarmkrebs: Trotz Verlängerung der Überlebenszeiten wird neuen innovativen Medikamenten der Zusatznutzen durch den Gemeinsamen Bundesausschuss (G-BA) in Frage gestellt.
Die DGHO Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie e.V. und die Arbeitsgemeinschaft für Internistische Onkologie (AIO) der Deutschen Krebsgesellschaft befürchten, dass diese Tendenz den Zugang zu neuen Arzneimitteln insbesondere für Krebspatienten in schwierigen oder fast aussichtslosen Situationen gefährdet.
In den letzten Wochen hat der Gemeinsame Bundesausschuss (G-BA) mehrfach die Festlegung „Zusatznutzen nicht belegt“ für Krebsmedikamente getroffen, obwohl diese die Überlebenszeit der Patienten verlängern. Auch wurde innovativen Präparaten für die chronische lymphatische Leukämie und das Lungenkarzinom kein Zusatznutzen gerade in den Patientengruppen zugesprochen, in denen der höchste, ungedeckte, medizinische Bedarf besteht.
Die frühe Nutzenbewertung nach dem Arzneimittelmarktneuordnungsgesetz (AMNOG) wurde 2010 mit dem Ziel eingeführt, den Zusatznutzen neuer Arzneimittel als Grundlage der Preisbildung zu verwenden. Das Verfahren ist aufwändig, umfasst Dossiers der pharmazeutischen Unternehmer von 1.000 und mehr Seiten, einen Bericht des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) bzw. des G-BA und eine Anhörung, an der auch die wissenschaftlichen medizinischen Fachgesellschaften beteiligt sind. Einer der großen Vorteile des Verfahrens liegt in wertvollen, zusätzlichen Informationen über neue Arzneimittel. Die Nutzenbewertung hat aus Sicht von DGHO und AIO bisher gut funktioniert. Sie muss ein lernendes System bleiben. Allerdings wurden in mehreren Verfahren der letzten Wochen vom G-BA überraschend negative Festlegungen getroffen. Sie sind Anlass, auf eine sich andeutende Fehlentwicklung hinzuweisen.
„Zusatznutzen nicht belegt“ trotz Verlängerung der Überlebenszeit
Bei drei im September 2016 abgeschlossenen Verfahren der frühen Nutzenbewertung (Ramucirumab beim Dickdarmkrebs, Ramucirumab beim Lungenkrebs, Necitumumab beim Lungenkarzinom) führt die Kombination der neuen Antikörper mit konventioneller Chemotherapie in großen randomisierten Studien zu einer signifikanten Verlängerung der mittleren Überlebenszeit, rechnerisch um 14 bis 21 Prozent gegenüber der Chemotherapie allein. Die Gabe dieser Antikörper ist mit Nebenwirkungen belastet, bei Ramucirumab u. a. mit einem stärkeren Abfall der weißen Blutkörperchen als mit Chemotherapie allein, mit Fatigue und mit erhöhtem Blutdruck. Bei Necitumumab tritt vor allem eine Hautreaktion auf.
In der Praxis werden Krebspatienten vor dem Therapiestart ausführlich über den Nutzen und die Nebenwirkungen neuer Arzneimittel aufgeklärt. Der Patient entscheidet, wie wichtig ihm die mögliche Verlängerung der Überlebenszeit gegenüber dem Risiko von Nebenwirkungen ist. Auch nach der Entscheidung für die Therapie mit einem neuen Arzneimittel kann er die Behandlung beim Auftreten belastender Nebenwirkungen jederzeit abbrechen.
Der G-BA hat in den drei Verfahren nicht aus dieser Patientensicht, sondern nach der Formel entschieden:
Verlängerung der Überlebenszeit – Nebenwirkungen = Zusatznutzen nicht belegt
Ähnlich war auch schon das Vorgehen zu Regorafenib beim Dickdarmkrebs im April 2016. Prof. Dr. Carsten Bokemeyer, Geschäftsführender Vorsitzender der Deutschen Gesellschaft für Hämatologie und Medizinische Onkologie erläutert: „Für viele Patienten ist eine mögliche Verlängerung der Überlebenszeit die dominierende Motivation für eine Krebstherapie. Dafür sind sie auch bereit, Nebenwirkungen zumindest bis zu einem bestimmten Ausmaß in Kauf zu nehmen.“
„Zusatznutzen nicht belegt“ trotz hoher Ansprechraten
Innerhalb bestimmter Krebskrankheiten können heute vielfach Subgruppen – oft auf der Basis molekularer Faktoren – mit besonders ungünstiger Prognose identifiziert werden. Bei der chronischen lymphatischen Leukämie gehören dazu Patienten mit del17p bzw. der TP53 Mutation. Der orale Kinase-Inhibitor Idelalisib führt bei dieser Hochrisikogruppe in Kombination mit Anti-CD20-Antikörper zu Remissionsraten von etwa 80 Prozent sowie einer signifikanten Verlängerung der progressionsfreien und der Gesamtüberlebenszeit. In der Neubewertung des Zusatznutzens von Idelalisib wurde der Subgruppe von Patienten mit del17p bzw. TP53 Mutation kein Zusatznutzen zuerkannt. „Idelalisib ist eine unverzichtbare Behandlungsoption für CLL-Patienten mit 17p- oder TP53 Mutation“, erklärt Prof. Dr. Michael Hallek, Vorsitzender der DGHO Deutschen Gesellschaft für Hämatologie und Onkologie und Leiter der deutschen CLL-Studiengruppe.
Eine prognostisch sehr ungünstige Gruppe beim EGFR-mutierten Lungenkarzinom sind Pati-enten mit einer T790M-Mutation. Sie sind resistent gegenüber den sonst hoch wirksamen Tyrosinkinase-Inhibitoren. Der neue Kinase-Inhibitor Osimertinib wirkt gezielt bei dieser vorbehandelten Patientengruppe mit einer Ansprechrate von über 60 Prozent und einer progressionsfreien Überlebenszeit von fast 10 Monaten. Auch Osimertinib wurde in der aktuellen Nutzenbewertung kein Zusatznutzen zugesprochen. „Osimertinib ist eine genau für einen spezifischen Resistenzmechanismus entwickelte Substanz mit hoher klinischer Wirksamkeit und guter Verträglichkeit. Ohne diese Substanz ist die optimale, gezielte Behandlung dieser gut definierten Subgruppe von Patienten mit einer EGFR-Resistenzmutation nicht gegeben“, so Prof. Dr. Martin Reck, Chefarzt des Onkologischen Schwerpunktes der Lungenfachklinik Grosshansdorf und Beisitzer im Vorstand der Arbeitsgemeinschaft Internistische Onkologie in der Deutschen Krebsgesellschaft (AIO).
DGHO und AIO plädieren für eine stärker patientenzentrierte Nutzenbewertung neuer Arzneimittel mit höherer Gewichtung von Endpunkten wie Überlebenszeit gegenüber potenziellen, reversiblen Nebenwirkungen. In der Praxis ist es ureigene ärztliche Aufgabe gemeinsam mit dem Patienten die Abwägung von individuell erzieltem Erfolg und individuell auftretender Toxizität kontinuierlich im Behandlungsverlauf neu zu bewerten. Auch plädieren wir für einen Fokus auf Patientengruppen mit ungedecktem, medizinischem Bedarf. Bei Vorliegen überzeugender Daten zum Ansprechen und zur Verträglichkeit sollte ein befristeter Zusatznutzen ausgesprochen werden. Unabhängige Register können helfen, den Zusatznutzen in der Versorgungsrealität zu quantifizieren. Durch die G-BA Festlegung „Zusatznutzen nicht belegt“ werden Patienten und verordnende Ärzte verunsichert mit dem Risiko, dass ein wirksames Präparat gar nicht eingesetzt wird.
Quelle: DGHO Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie e.V. sowie Arbeitsgemeinschaft internistische Onkologie (AIO) der Deutschen Krebsgesellschaft e.V.
Hautkrebs: Novartis Pharma startet neues Informationsangebot mit www.leben-mit-hautkrebs.de
Hautkrebs ist eine der häufigsten Krebserkrankungen weltweit. Allein in Deutschland gibt es jährlich über 263.800 Neuerkrankungen.
Eine nützliche Informationsquelle zum vielschichtigen Themenspektrum Hautkrebs bietet die neue Website www.leben-mit-hautkrebs.de. Das Serviceangebot von Novartis Oncology richtet sich an Patienten, Angehörige und Interessierte. Umfangreiche Hintergrundinformationen zur Erkrankung sowie zu Erkennungsmöglichkeiten, Therapieprinzipien und Behandlungsmethoden können Betroffene in verschiedenen Phasen der Erkrankung unterstützen. Als weitere Services stehen beispielsweise praktische Tipps zur Selbstuntersuchung und ein Leitfaden für das Gespräch mit dem behandelnden Arzt zum Download zur Verfügung.
Um Aufmerksamkeit für die Erkrankung und Vorsorge zu schaffen, wurde sogar der Monat Mai zum Hautkrebsmonat ausgerufen. Denn gerade mit Beginn der warmen Jahreszeit zieht es viele ungeschützt in die Sonne, wodurch das Risiko für Hautkrebs steigen kann.
Die gute Nachricht: Die meisten Hautkrebsarten lassen sich gut behandeln. Doch gibt es auch bösartige Hautkrebsvarianten: Das maligne Melanom, auch „schwarzer Hautkrebs“ genannt, stellt die aggressivste Form von Hautkrebs dar und neigt dazu, andere Körperbereiche zu befallen. Die Behandlung vom schwarzen Hautkrebs ist erschwert und die Prognose für den Patienten meist ungünstig.
Hautkrebs verstehen – erkennen – behandeln
„leben-mit-hautkrebs.de“ bündelt Informationen zum Krankheitsbild und liefert Antworten auf häufige Fragen aus Patientensicht. So werden Ursachen und Risikofaktoren, die für die Entstehung von Hautkrebs eine Rolle spielen können, umfassend beleuchtet sowie bewährte Diagnose- und Screeningverfahren allgemeinverständlich vorgestellt. Das verfügbare Behandlungsspektrum wird von operativen Verfahren oder Bestrahlungs- und Chemotherapie bis hin zu modernen, zielgerichteten medikamentösen Therapien differenziert abgebildet. Verlinkungen zu Selbsthilfegruppen oder weiterführenden Informationsquellen inklusive Tipps für die Arztsuche runden das Angebot ab.
Das ABC der Selbstkontrolle: Warnsignale richtig deuten
Je früher Hautkrebs erkannt wird, desto günstiger sind oftmals die Heilungschancen.4 Neben den Vorsorgeuntersuchungen der gesetzlichen Krankenkassen können Patienten selbst einen entscheidenden Beitrag zur Früherkennung von Hautveränderungen leisten. Die ABCDE-Regel5 ist ein bewährtes Instrument, um Auffälligkeiten und erste Warnsignale für ein Melanom zu erfassen und im Gespräch mit dem behandelnden Arzt anzumerken. Darüber hinaus bietet „leben-mit-hautkrebs.de“ eine Checkliste um festzustellen, ob individuelle Hautmerkmale möglicherweise auf ein potenziell erhöhtes Erkrankungsrisiko hindeuten. Die Selbsteinschätzung sollte anschließend gemeinsam mit einem Dermatologen besprochen werden.6
Checkliste zur Selbsteinschätzung des Hautkrebsrisikos für das Gespräch beim Hautarzt
□ Meine Haut bräunt leicht, beim Sonnen habe ich keine Probleme
□ Bei mir kommt es immer schnell zu Sonnenbrand
□ Meine Haut ist blass, ich habe Sommersprossen
□ Ich habe Verwandte mit blasser Haut und Sommersprossen
□ Ich habe so gut wie keine Pigmentmale
□ Ich habe viele Pigmentmale
□ Ich habe Pigmentmale, die seit Jahren unverändert sind
□ Ich habe nur Pigmentmale, die kleiner als zwei Millimeter sind
□ Einige meiner Pigmentmale sind größer als zwei Millimeter
□ Ich habe ein Pigmentmal, das angeboren und größer als zwei Zentimeter ist
□ Ein Pigmentmal ist in letzter Zeit neu entstanden
□ Mit einem meiner Pigmentmale könnte etwas nicht in Ordnung sein
Quelle: Novartis Pharma GmbH – vom 4. April 2016