Archiv für die Kategorie „Sonstige“
COMPASS: Wegweiser zu neuen Therapien für krebskranke Kinder

Wenn bei der Behandlung krebskranker Kinder Standardtherapien versagen, können molekulare Verfahren den Weg zu neuen, zielgerichteten Medikamenten weisen. Doch was, wenn diese allein nicht den erhofften Schlüssel zum Behandlungserfolg liefern? “Dann wenden wir Techniken der Hochdurchsatzmikroskopie an, um zu untersuchen, ob das Tumorgewebe auf bestimmte Medikamente anspricht, und erweitern somit die Diagnostik um eine wertvolle Dimension”, so Olaf Witt, Direktor des Translationalen Programmes am KiTZ und Leiter der Klinischen Kooperationseinheit Pädiatrische Onkologie des Deutschen Krebsforschungszentrums und des Universitätsklinikums Heidelberg. “Kombiniert man die funktionalen Bilddaten mit den Informationen, die man durch die molekularen Analysen erhält, so bekommt man genauere Hinweise auf erfolgversprechende Therapieansätze bei bisher unheilbaren Krebserkrankungen im Kindesalter.”
“Ziel ist es, auf der Grundlage der Bildanalysen und begleitender molekularer Analysen eine internationale, standardisierte und validierte Bibliothek für Medikamententests aufzubauen, die verschiedene Tumorarten auf ihr Ansprechen auf unterschiedliche Wirkstoffe hin charakterisiert und eingruppiert”, erklärt KiTZ Mitarbeiterin Sina Oppermann, wissenschaftliche Koordinatorin des COMPASS Projektes. “Diese Daten sollen am KiTZ langfristig in klinischen Studien übersetzt werden, damit betroffene Kinder möglichst schnell von den Erkenntnissen profitieren.”
Genau diesen Ansatz verfolgt das neue Projektes COMPASS (Clinical implementation Of Multidimensional PhenotypicAl drug SenSitivities in paediatric precision oncology), das vom europäischen Konsortium ERA PerMed mit 1,5 Millionen Euro über einen Zeitraum von drei Jahren finanziert wird. ERA PerMed ist ein Zusammenschluss, der sich auf die Förderung von Projekten der personalisierten Medizin konzentriert und sich aus 32 Partnern aus über 23 Ländern zusammensetzt. Er wird von der Europäischen Kommission mitfinanziert. Das Hopp-Kindertumorzentrum Heidelberg (KiTZ) koordiniert das vom europäischen Konsortium ERA PerMed mit 1,5 Millionen Euro geförderte Projekt, an dem neben dem KiTZ wissenschaftliche Einrichtungen aus Frankreich, Holland, Finnland und Ungarn beteiligt sind. Das Hopp-Kindertumorzentrum Heidelberg (KiTZ) ist eine gemeinsame Einrichtung des Deutschen Krebsforschungszentrums (DKFZ), des Universitätsklinikums Heidelberg und der Universität Heidelberg.
Neben dem KiTZ mit seiner europäischen kinderonkologischen Plattform “INFORM” gehören fünf weitere wissenschaftliche Einrichtungen zu den Partnern im COMPASS Projekt: das Institute Curie (Paris, Frankreich), Princess Máxima Center für pädiatrische Onkologie (Utrecht, Niederlande), Akademisch Medizinisches Zentrum der Universität Amsterdam (AMC) (Amsterdam, Niederlande), Institut für Molekulare Medizin Finnland (FIMM) und Universität Helsiniki (Finnland) sowie das Startup Unternehmen Single Cell Technologies Inc. (Szeged, Ungarn).
Quelle: DKFZ – Pressestelle / KiTZ Hopp-Kindertumorzentrum Heidelberg, eine gemeinsame Einrichtung des Deutschen Krebsforschungszentrums (DKFZ), des Universitätsklinikums Heidelberg und der Universität Heidelberg
Leberkrebs – Internationale Online-Patientenbefragung
ELPA, die Europäische Leber Patientenorganisation lädt gemeinsam mit weiteren globalen Leberkrebs-Organisationen Betroffene ein, an einer weltweiten Online – Leberkrebs-Patientenbefragung teilzunehmen.

Der Onlinefragebogen wurde von einem Wissenschaftlichen Forschungsinstitut in Zusammenarbeit mit den internationalen Leberkrebsgruppen erstellt. Die Ergebnisse der Studie dienen der Verbesserung der Forschungsgrundlage und werden nach ihrer Auswertung der Öffentlichkeit zugänglich gemacht.
Homepage der Onlinebefragung: www.hcc-voices.com
Stammzellforschung – Von der Krebsursache zum medizinischen Fortschritt
Zum nunmehr sechsten mal richtet das Deutsche Krebsforschungszentrum (DKFZ) vom 18. bis 20. September 2016 das Internationale Heinrich F.C. Behr-Symposium aus, dass alle zwei Jahre stattfindet. Rund 400 Experten aus aller Welt tauschen sich aus, um über Stammzellen, Krebs und Krebsstammzellen zu berichten und zu diskutieren.
“…Wir sind davon überzeugt, dass dieses Forschungsgebiet die Behandlung von Krebspatienten in Zukunft entscheidend beeinflussen und verbessern wird”, sagt Michael Boutros, der kommissarische Wissenschaftliche Vorstand des DKFZ. “Das zeigen allein schon einige der Ergebnisse, die auf dem diesjährigen Symposium vorgestellt werden.” “Die Krebsstammzellforschung ist in der Medizin angekommen”, freut sich Andreas Trumpp vom DKFZ und von HI-STEM, dem “Heidelberger Institut für Stammzellforschung und experimentelle Medizin, das das DKFZ mit der Dietmar Hopp Stiftung gegründet hat. “Die Aufklärung der Tricks der Krebsstammzellen liefert uns wertvolle Ideen für die Therapie, die wir nun beginnen umzusetzen. Und mit 3D-Kulturen von Tumoren können wir das Tumorgeschehen in der Petrischale nachahmen und gleichzeitig Strategien für die Behandlung entwickeln.”
Erblich bedingten Brustkrebs
Von der Stammzellforschung zur Brustkrebs-Prävention – das ist das Ziel von Jane Visvader vom Walter and Eliza Hall Institute in Melbourne, Australien. 2006 ist es ihr als erster gelungen, die Brustdrüsen-Stammzellen zu identifizieren. Nun hat sie herausgefunden, wie genetische Veränderungen bestimmte Tochterzellen dieser Stammzellen zu einer besonders gefährlichen Form von Brustkrebs entarten lassen, und wie man diesen Prozess mit einem Medikament verhindern kann. Dies könnte die Prävention von erblich bedingtem Brustkrebs erheblich verbessern, als Alternative zur bisher oft vorgenommenen Radikaloperation.
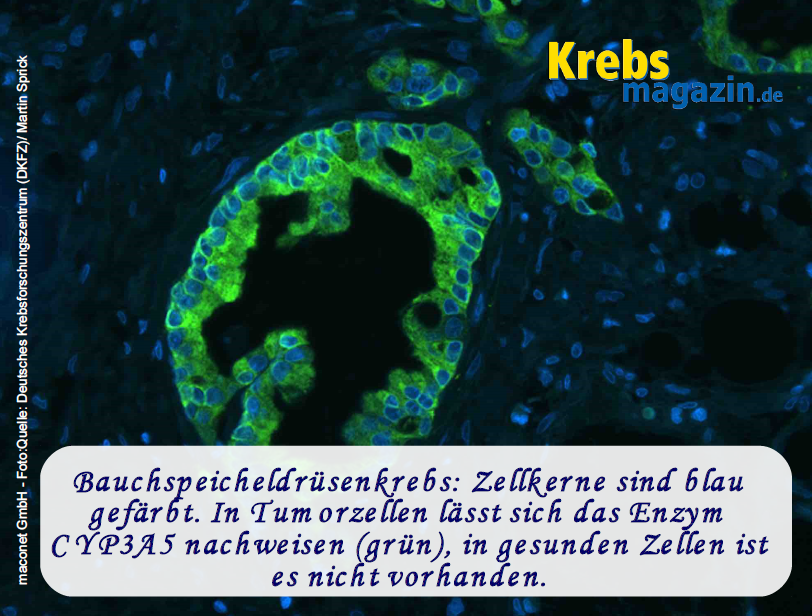
Bauchspeicheldrüsenkrebs
Andreas Trumpp berichtet darüber, wie verschiedene Krebsstammzellen unterschiedliche Typen von Bauchspeicheldrüsenkrebs hervorrufen. Auf der Basis dieser Forschung fand er heraus, warum einer der Subtypen von Bauchspeicheldrüsenkrebs so besonders resistent gegen Chemotherapien ist und wie sich hieraus ein neuer Ansatz ergeben könnte, um wirksamere Therapien zu entwickeln.
Organoide zum besseren Verständnis für Organentwicklung und Krankheitsentstehung
Ein besonders spannendes Thema der aktuellen Stammzellforschung sind so genannte Organoide, in der Kulturschale aus Stammzellen gezüchtete organähnliche Strukturen. Für die Grundlagenforschung haben sie großes Potential, um beispielsweise zu verstehen, wie sich Organe entwickeln oder wie Krankheiten entstehen. In der medizinischen Forschung verspricht man sich Fortschritte bei der Entwicklung von Organersatz, sie gelten außerdem als ideal, um neue Wirkstoffe zu erproben.
Gehirn in der Kulturschale
Jürgen Knoblich vom Institut für Molekulare Biotechnologie in Wien stellt das besonders aufsehenerregende und hochkomplexe menschliche “Gehirn in der Kulturschale” vor, das tatsächlich aus verschiedenen gehirntypischen Strukturen aufgebaut ist und aktive Nervenzellen enthält.
Organoide aus patienteneigenen Krebszellen zur zielgerichteten Therapie
Dem niederländischen Stammzellforscher Hans Clevers vom Hubrecht Institut für Entwicklungsbiologie und Stammzellforschung in Utrecht ist es erstmals gelungen, Organoide aus patienteneigenen Krebszellen zu züchten. An diesen Gewebestrukturen können die Wissenschaftler und Ärzte prüfen, welche zielgerichteten Medikamente oder Medikamentenkombinationen am wirksamsten sind und so die Therapie vorab an den individuellen Tumor anpassen.
Quelle: Deutsches Krebsforschungszentrum (DKFZ), Internationale Heinrich F.C. Behr-Symposium, 18. bis 20. September 2016
Hautkrebs: Novartis Pharma startet neues Informationsangebot mit www.leben-mit-hautkrebs.de
Hautkrebs ist eine der häufigsten Krebserkrankungen weltweit. Allein in Deutschland gibt es jährlich über 263.800 Neuerkrankungen.
Eine nützliche Informationsquelle zum vielschichtigen Themenspektrum Hautkrebs bietet die neue Website www.leben-mit-hautkrebs.de. Das Serviceangebot von Novartis Oncology richtet sich an Patienten, Angehörige und Interessierte. Umfangreiche Hintergrundinformationen zur Erkrankung sowie zu Erkennungsmöglichkeiten, Therapieprinzipien und Behandlungsmethoden können Betroffene in verschiedenen Phasen der Erkrankung unterstützen. Als weitere Services stehen beispielsweise praktische Tipps zur Selbstuntersuchung und ein Leitfaden für das Gespräch mit dem behandelnden Arzt zum Download zur Verfügung.
Um Aufmerksamkeit für die Erkrankung und Vorsorge zu schaffen, wurde sogar der Monat Mai zum Hautkrebsmonat ausgerufen. Denn gerade mit Beginn der warmen Jahreszeit zieht es viele ungeschützt in die Sonne, wodurch das Risiko für Hautkrebs steigen kann.
Die gute Nachricht: Die meisten Hautkrebsarten lassen sich gut behandeln. Doch gibt es auch bösartige Hautkrebsvarianten: Das maligne Melanom, auch „schwarzer Hautkrebs“ genannt, stellt die aggressivste Form von Hautkrebs dar und neigt dazu, andere Körperbereiche zu befallen. Die Behandlung vom schwarzen Hautkrebs ist erschwert und die Prognose für den Patienten meist ungünstig.
Hautkrebs verstehen – erkennen – behandeln
„leben-mit-hautkrebs.de“ bündelt Informationen zum Krankheitsbild und liefert Antworten auf häufige Fragen aus Patientensicht. So werden Ursachen und Risikofaktoren, die für die Entstehung von Hautkrebs eine Rolle spielen können, umfassend beleuchtet sowie bewährte Diagnose- und Screeningverfahren allgemeinverständlich vorgestellt. Das verfügbare Behandlungsspektrum wird von operativen Verfahren oder Bestrahlungs- und Chemotherapie bis hin zu modernen, zielgerichteten medikamentösen Therapien differenziert abgebildet. Verlinkungen zu Selbsthilfegruppen oder weiterführenden Informationsquellen inklusive Tipps für die Arztsuche runden das Angebot ab.
Das ABC der Selbstkontrolle: Warnsignale richtig deuten
Je früher Hautkrebs erkannt wird, desto günstiger sind oftmals die Heilungschancen.4 Neben den Vorsorgeuntersuchungen der gesetzlichen Krankenkassen können Patienten selbst einen entscheidenden Beitrag zur Früherkennung von Hautveränderungen leisten. Die ABCDE-Regel5 ist ein bewährtes Instrument, um Auffälligkeiten und erste Warnsignale für ein Melanom zu erfassen und im Gespräch mit dem behandelnden Arzt anzumerken. Darüber hinaus bietet „leben-mit-hautkrebs.de“ eine Checkliste um festzustellen, ob individuelle Hautmerkmale möglicherweise auf ein potenziell erhöhtes Erkrankungsrisiko hindeuten. Die Selbsteinschätzung sollte anschließend gemeinsam mit einem Dermatologen besprochen werden.6
Checkliste zur Selbsteinschätzung des Hautkrebsrisikos für das Gespräch beim Hautarzt
□ Meine Haut bräunt leicht, beim Sonnen habe ich keine Probleme
□ Bei mir kommt es immer schnell zu Sonnenbrand
□ Meine Haut ist blass, ich habe Sommersprossen
□ Ich habe Verwandte mit blasser Haut und Sommersprossen
□ Ich habe so gut wie keine Pigmentmale
□ Ich habe viele Pigmentmale
□ Ich habe Pigmentmale, die seit Jahren unverändert sind
□ Ich habe nur Pigmentmale, die kleiner als zwei Millimeter sind
□ Einige meiner Pigmentmale sind größer als zwei Millimeter
□ Ich habe ein Pigmentmal, das angeboren und größer als zwei Zentimeter ist
□ Ein Pigmentmal ist in letzter Zeit neu entstanden
□ Mit einem meiner Pigmentmale könnte etwas nicht in Ordnung sein
Quelle: Novartis Pharma GmbH – vom 4. April 2016
Nieren- und Blasenkrebs: Neuer Therapieansatz in der Immunonkologie erwartet
Eine Tumorerkrankung mit dem eigenen Immunsystem angreifen? Genau dieser Mechanismus wird durch verschiedene neue Substanzen aus dem Bereich der „Immunonkologie“ verfolgt. Im Gegensatz zu herkömmlichen Therapieansätzen, wie der Chemotherapie, bei denen der Tumor direktes Ziel des Wirkstoffes ist, funktionieren die Immunonkologika über eine verstärkte Immunantwort und die daraus resultierende anti-tumoröse Wirkung der körpereigenen Abwehr.
„Dieser Mechanismus greift auch bei urologischen Tumoren und wird die Therapievielfalt beim metastasierten Nierenzellkarzinom und beim metastasierten Harnblasenkarzinom in Kürze erweitern“, sagt Prof. Dr. Christian Wülfing, Pressesprecher der Deutschen Gesellschaft für Urologie e.V. (DGU) angesichts der bevorstehenden Zulassung neuer Wirkstoffe in der uroonkologischen Immuntherapie. Jährlich erkranken laut Statistik des Robert Koch-Instituts in Deutschland rund 15 000 Männer und Frauen neu an Nierenkrebs und etwa 29 000 an Blasenkrebs.
 Prof. Dr. Christian Wülfing, Urologie, Asklepios Klinik Altona
Prof. Dr. Christian Wülfing, Urologie, Asklepios Klinik Altona
Schlüssel für den Fortschritt im Kampf gegen Krebs sind die „T-Zellen“. Prof. Wülfing: „Die körpereigenen zytotoxischen T-Zellen, die in der Lage sind, körperfremde Zellen – auch Tumorzellen – zu erkennen und zu zerstören, werden durch ein komplexes Zusammenspiel bestimmter aktivierender und hemmender Signale gesteuert. Diese sogenannten Immun-Checkpoints steuern die Zerstörung von fremden Zellen, verhindern dabei aber eine dauerhafte Immunantwort und somit eine Schädigung gesunden Gewebes. Die wichtigsten Regulatoren in diesem Zusammenspiel sind die PD-1-/PD-L1- und die CTLA-4 Signalwege, die in den letzten Jahren in den Fokus der pharmakologisch-onkologischen Forschung kamen.“ Verschiedene neue Wirkstoffe, die diese Signalwege anzielen, konnten synthetisiert und in klinische Studien eingebracht werden.
Zwei dieser neuen Substanzen zeigen in aktuellen Studien ein deutlich verlängertes Überleben für Patienten mit metastasiertem Nierenzellkarzinom (mNZK) und für Patienten mit metastasiertem Harnblasenkarzinom. Der Wirkstoff Nivolumab wurde in einer randomisierten Phase-III Studie zur Zweitlinientherapie des mNZK (Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma, Robert J. Motzer et al.) getestet. Insgesamt 821 Patienten wurden in den Nivolumab- oder Everolimus-Therapiearm randomisiert. Es fand sich ein Gesamtüberleben von 25,0 versus 19,6 Monaten, was einer 23%igen Verringerung des Sterberisikos entsprach.
Beim metastasierten Harnblasenkarzinom wurde die Substanz Atezolizumab in einer Phase-II Studie getestet, die zuletzt im Januar 2016 in San Francisco vorgestellt wurde (IMvigor 210, a phase II trial of atezolizumab (MPDL3280A) in platinum-treated locally advanced or metastatic urothelial carcinoma (mUC)). Hier konnten 310 Patienten eingeschlossen und im Sinne einer Zweitlinientherapie nach Cisplatin-Therapieversagen behandelt werden. Abhängig von der PD-L1-Expression im Tumorgewebe konnte ein objektives Ansprechen in bis zu 26% und ein Überleben von bis zu 11.4 Monaten erzielt werden.
„Erfreulicherweise gingen die Behandlungen mit diesen innovativen Substanzen insgesamt mit einem sehr günstigen Toxizitätsprofil einher“, sagt der DGU-Pressesprecher. So scheinen die Wirkstoffe nur sehr selten höhergradige Nebenwirkungen auszulösen. Selten scheint auch mit immunvermittelten Nebenwirkungen wie Durchfall und Bauchkrämpfen oder Störungen der Hormonproduktion und -regulation zu rechnen zu sein, deren Behandlung, laut Prof. Wülfing, geschult erfolgen müsse.
Während Atezolizumab zunächst in einem klinischen Studienprogramm weiter verfolgt und derzeit in einer Phase-III Studie zur unterstützenden Therapie nach Entfernung der Harnblase (adjuvante Therapie) getestet wird, ist der klinische Einsatz von Nivolumab zur Immuntherapie beim metastasierten Nierenzellkarzinom in Deutschland in Kürze zu erwarten. Prof. Wülfing: „Nachdem die amerikanische Zulassungsbehörde FDA aufgrund der dargestellten Studienergebnisse Nivolumab Ende 2015 die Marktfreigabe für die Indikation fortgeschrittenes Nierenzellkarzinom erteilt hat, ist in den nächsten Monaten mit der europäischen Zulassung zu rechnen.“ Ein wichtiger Schritt dahin ist getan: Aktuell hat der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur (EMA) die Indikationserweiterung empfohlen. Die Empfehlung wird nun von der Europäischen Kommission, die über die Zulassung von Arzneimitteln in den Mitgliedsstaaten entscheidet, geprüft. Nivolumab ist bereits bei metastasiertem Lungen- und Hautkrebs zugelassen.
„Im nächsten Schritt geht es um die Frage nach der besten Therapiesequenz in der Uroonkologie, das heißt der individuell optimalen Anwendung des neuen Wirkstoffs“, sagt DGU- und Kongresspräsident Prof. Dr. Kurt Miller und verweist auf den 68. Kongress der Deutschen Gesellschaft für Urologie e.V. vom 28. September bis 1. Oktober 2016 in Leipzig, wo die Immuntherapie des mNZK zu den vielversprechendsten wissenschaftlichen Themen zählt.
Quelle: Deutsche Gesellschaft für Urologie (DGU e.V.)
TOP-Infos zu modernen Krebsmedikamenten: Arzneimittel bewertung wird neue Rubrik auf Onkopedia.com
 Prof. Dr. Diana Lüftner, Oberärztin an der Medizinischen Klinik mit Schwerpunkt Hämatologie und Onkologie an der Berliner Charité.
Prof. Dr. Diana Lüftner, Oberärztin an der Medizinischen Klinik mit Schwerpunkt Hämatologie und Onkologie an der Berliner Charité.Mehr Impfen! – Der Krebsprävention eine Chance geben:
Nobelpreisträger Harald zur Hausen ruft anlässlich des diesjährigen Weltkrebstages dazu auf, die Impfung gegen krebserregende humane Papillomviren (HPV) intensiver zu nutzen.
Prof. Dr. Harald zur Hausen, erhielt 2008 den Nobelpreis f. Medizin für seine Arbeit zu HPV Viren.
Bereits 1976 publizierte er die Hypothese, dass humane Papillomviren (Warzenviren) eine Rolle bei der Entstehung von Gebärmutterhalskrebs (Zervixkarzinom) spielten. Aus dem Verdacht wurde bald experimentell untermauerte wissenschaftliche Gewissheit. Anfang der 1980er Jahre konnte er mit seiner Arbeitsgruppe erstmals die Typen HPV 16 und HPV 18 des humanen Papillomvirus aus an Gebärmutterhalskrebs erkranktem Gewebe isolieren. Die Entdeckung des Auslösers der bei Frauen dritthäufigsten Krebserkrankung eröffnete völlig neue Perspektiven der Vorbeugung und Behandlung und führte letztlich zur Entwicklung von HPV-Impfstoffen, die seit 2006 verfügbar sind. (Quelle: WIKIPEDIA)“We can. I can.” – das Motto des Weltkrebstags am 4. Februar erinnert daran:
Jeder kann dazu beitragen, sein persönliches Krebsrisiko zu senken, etwa
- durch einen gesunden Lebensstil und
- durch die Teilnahme an Früherkennungsuntersuchungen.
- Eine weitere Möglichkeit, sich vor Krebs zu schützen, ist die Impfung gegen krebserregende humane Papillomviren (HPV). In Deutschland wird die HPV-Impfung für Mädchen im Alter zwischen 9 und 14 Jahren empfohlen. Der kürzlich erschienene Impfreport des Robert Koch-Instituts zeigt jedoch, dass hierzulande gerade mal 29 Prozent der 15-jährigen Mädchen den vollen Impfschutz haben.
Herr zur Hausen, in Deutschland ist nur etwa ein Drittel der Mädchen gegen HPV geimpft. Woran könnte das liegen?
Zur Hausen: Ein sehr trauriges Ergebnis! Die Hauptursache dafür ist sicherlich, dass Ärzte, medizinisches Personal und Gesundheitspolitiker, aber auch die Kinder und ihre Lehrer und Eltern nicht genügend über die sehr hohe Wirksamkeit und Sicherheit der HPV-Impfung informiert sind. So beobachten wir bei den Geimpften einen nahezu hundertprozentigen Schutz vor Infektion mit HPV 16 und 18, den häufigsten Krebserregern unter den Papillomviren. Bei anderen Impfungen, etwa gegen Hepatitisviren, kommt es dagegen in etwa fünf Prozent der Fälle zu Impfversagern.
Auf der anderen Seite ist die Impfung sehr sicher: Es ist nur eine Nebenwirkung auf etwa eine Million Impfdosen dokumentiert. Und dabei handelt es sich meist nicht um bedrohliche Symptome.
Gibt es bereits Zahlen zum Rückgang von Gebärmutterhalskrebs?
Zur Hausen: Weil es nach einer HPV-Infektion schätzungsweise 15 bis 30 Jahre dauert, bis eine Krebserkrankung festgestellt wird, ist es derzeit noch zu früh für statistisch gesicherte Aussagen zum Rückgang von Gebärmutterhalskrebs unter den Geimpften. Aber der signifikante Rückgang von Krebsvorstufen, aus denen mit einer hohen Wahrscheinlichkeit Krebs entsteht, spricht eine deutliche Sprache.
Sie sind ein Wegbereiter der HPV-Impfung. Wie ist es für sie persönlich, wenn Sie von den niedrigen Impfquoten hierzulande lesen?
Zur Hausen: Ich muss wirklich sagen, das ärgert mich. Was mich noch mehr ärgert als die Verweigerung der Impfung durch Eltern und Kinder, ist die immer wieder beobachtete Ignoranz einiger Mediziner, die sich nicht hinreichend informiert haben. Man muss mal ganz dramatisch darauf hinweisen, was es bedeutet, die Impfung auszulassen: Heute erkranken etwa 6000 Frauen an Gebärmutterhalskrebs und ungefähr 2500 von ihnen sterben daran. Man kann also eine einfache Rechnung anstellen, wie es sich später auswirkt, wenn über die Hälfte der Mädchen nicht geimpft sind.
Wie könnte man den Impfschutz in Deutschland verbessern?
Zur Hausen: Neben einer kontinuierlichen Aufklärung halte ich Impfprogramme in Schulen für sinnvoll. Das machen uns beispielsweise die Briten und Australier vor, dort erreichen die Impfraten über 80 Prozent. Gerade wurde in Hessen ein Modellversuch gestartet, um zu erproben, ob das auch eine Option für Deutschland ist.
Am meisten könnten wir meiner Meinung nach erreichen, wenn auch bei uns die Jungs geimpft würden. Das ist eine geradezu zwingende Forderung, denn in nahezu allen Kulturen haben die jungen Männer mehr Sexualpartner als Frauen der gleichen Altersgruppe und sind damit die wichtigsten Verbreiter der Infektion. Ganz plakativ gesagt: Würden wir nur die Jungs impfen, würden wir wahrscheinlich mehr Fälle von Gebärmutterhalskrebs verhüten als mit der ausschließlichen Impfung der Mädchen!
Gibt es auch gute Nachrichten?
Zur Hausen: Mit den heutigen Impfstoffen gegen HPV16 und 18 lässt sich das Auftreten von Gebärmutterhalskrebs voraussichtlich um 70 Prozent reduzieren, wahrscheinlich sogar um 80 Prozent wegen der Kreuzimmunität. Ein Impfstoff, der gegen neun verschiedene krebserregende HPV-Typen gerichtet ist, wird derzeit klinisch erprobt und könnte vermutlich gegen mehr als 90 Prozent der Krebsfälle schützen. Ein anderes Unternehmen entwickelt sogar einen Impfstoff, der eine Komponente der Virushülle beinhaltet, die in fast allen HPV-Typen vorkommt und damit neben dem Krebsschutz auch Schutz vor vielerlei Warzen verspricht.
Quelle: Deutsches Krebsforschungszentrum (DKFZ), Heidelberg
Genetisches Profiling – In der Krebsmedizin ist die genetische Diagnostik mittlerweile unverzichtbar
Anlässlich des 32. Deutschen Krebskongresses 2016 in dessen Rahmen am 27. Februar auch der Krebsaktionstag für Laien und Betroffene angeboten wird, hat die Deutsche Krebsgesellschaft e.V. und die Deutsche Krebshilfe gemeinsam mit der Berliner Krebsgesellschaft drei Referenten interviewt, die wir hier ungekürzt veröffentlichen möchten.
Noch vor wenigen Jahren war die DNA-Sequenzierung ausschließlich ein Werkzeug der Grundlagenforscher zur Entschlüsselung des genetischen Codes. Mittlerweile hat diese Technik Einzug in die Klinik gehalten. Denn Genmutationen, die man im Tumor findet, können wertvolle Informationen für die gezielte Therapieauswahl liefern.
Prof. Dr. Christoph Röcken, Sprecher der Arbeitsgemeinschaft Onkologische Pathologie in der Deutschen Krebsgesellschaft, erklärt im Interview, wie ein genetisches Tumorprofil erstellt wird und beschreibt die Herausforderungen.
Herr Professor Röcken, können Sie Beispiele nennen, wo eine Genveränderung im Erbgut des Tumors heute schon den Weg zur gezielten Therapie weist?
Das gilt mittlerweile beim Dickdarmkrebs, beim Lungenkrebs, beim schwarzen Hautkrebs, bei Hirntumoren und seit 2015 auch beim Eierstockkrebs. Bei diesen Krebsarten erhalten Pathologen häufig den Auftrag, herauszufinden, ob der Tumor bestimmte Mutationen trägt.
Wie wird das Ausgangsmaterial für die Analyse gewonnen?
Wir starten mit Biopsiematerial oder mit Tumorgewebe aus einer OP und fertigen daraus zunächst Gewebeschnitte an. Anschließend grenzen wir unter dem Mikroskop das Tumorareal ein und berücksichtigen dabei die Heterogenität des Tumors. Die fraglichen Areale werden gezielt herauspräpariert (mikrodisseziert), man gewinnt daraus die DNA und untersucht sie anschließend mit einer DNA-Sequenzierung auf Mutationen.
Welche Sequenzierungsmethoden kommen dabei zum Einsatz?
In der diagnostischen Routine geht es häufig um die Frage, ob ein bestimmtes Gen eine bestimmte Mutation trägt. D.h. der entsprechende Gen-Abschnitt wird zunächst vervielfältigt und dann einer klassischen Sanger-Sequenzierung unterzogen. Mittlerweile sind aber viele Gene bekannt, die in der Diagnostik und Therapie eine Bedeutung haben. Will man die alle mit der klassischen Methode überprüfen, muss man jedes Gen einzeln sequenzieren – ein enormer Zeitaufwand. Das Next Generation Sequencing, kurz NGS, erlaubt die parallele Sequenzierung vieler Gene. Damit lassen sich z. B. 10 bis 40 Gene auf einmal untersuchen, und zwar in einer sogenannten Panel-Sequenzierung. Das steigert die Effizienz der Sequenzierung enorm.
Mit sogenannten Liquid Biopsies wollen die Experten mittlerweile auch im Blut nach der mutierten Krebs-DNA suchen. Wie zuverlässig ist diese Diagnostik?
Dass Tumor-DNA oder auch Tumorzellen im Blut vorkommen, weiß man schon länger. Hämatologen nutzen das bei bestimmten Leukämien, und zwar zur Bestimmung der Resterkrankung nach der Therapie. Diese Leukämien tragen eine charakteristische Mutation; je geringer die Konzentration an mutierter DNA im Blut, desto geringer die minimale Resterkrankung. Auch solide Tumoren können beim Untergang von Tumorzellen DNA ins Blut freisetzen. Das gilt allerdings nicht für alle Tumorarten in jedem Tumorstadium. Annähernd 100% der Patienten mit fortgeschrittenem Darmkrebs weisen zirkulierende Tumor-DNA im Blut auf, nur 40% beim Prostata- oder Nierenkarzinom, und beim Hirntumor findet man gar keine Tumor-DNA im Blut.
Gibt es noch weitere Einschränkungen?
Man muss die Mutation, nach der gesucht werden soll, genau kennen. Eine Liquid Biopsy zur Suche nach einer Genveränderung, die der Tumor gar nicht trägt, macht keinen Sinn. An der Erstellung eines genetischen Profils des Tumors kommt man also nicht vorbei. Außerdem kommen einige der Mutationen, die wir in bösartigen Tumoren finden, auch bei gutartigen Tumoren vor. Insgesamt ist also noch einiges an Standardisierung und Qualitätssicherung nötig, bevor die Liquid Biopsy bei Patienten mit soliden Tumoren routinemäßig angewendet werden kann. Zur Überprüfung des Therapieansprechens bei Patienten mit einer hohen Tumorlast könnten Liquid Biopsies aber durchaus nützlich sein.
Was verändert sich durch die genetische Diagnostik in der Pathologie?
Für die Einteilung von Tumoren ist sie mittlerweile unverzichtbar und ich sehe darin eine große Chance, um die Therapie noch genauer auf die Biologie des Tumors abstimmen zu können. Natürlich unterliegt diese Art der Diagnostik einer großen Dynamik, und wir sind gefordert, mit dem raschen Zuwachs an Wissen und der Entwicklung neuer Methoden Schritt zu halten. Deshalb sind Kongresse wie der DKK 2016 wichtig, bei dem die Experten zusammenkommen, um ihr Wissen auszutauschen. Vor allem im translationalen Programmteil des DKK 2016 sind die Themen Molecular Diagnostics, Next Generation Sequencing und Liquid Biopsy vertreten. Ich verspreche mir interessante Beiträge und spannende Sitzungen vom DKK 2016.
Quelle: Deutsche Krebsgesellschaft, Deutsche Krebshilfe