Archiv für die Kategorie „Therapien“
ZNS-Lymphome: Neuer Therapieansatz bei aggressivem Hirntumor
Die Therapie des primären ZNS-Lymphoms, einer seltenen und sehr aggressiven Lymphom- bzw. Hirntumorart, ist ausgesprochen schwierig. Vor allem Patienten, die nicht auf die Ersttherapie ansprechen oder einen Rückfall erleiden, haben eine schlechte Prognose. In der internationalen Fachzeitschrift Journal of Clinical Oncology (JCO) haben Wissenschaftler der Deutschen Studiengruppe für Primäre ZNS-Lymphome (G-PCNSL-SG) mit Sitz an der Charité Berlin nun die Ergebnisse einer Phase-II-Studie mit dem Wirkstoff Temsirolimus publiziert. Zwar stellen die Ergebnisse keinen Therapiedurchbruch dar, eröffnen aber neue Perspektiven für Patienten und dokumentieren den Erfolg deutscher Wissenschaftler in der Hirntumorforschung.
Primäre ZNS-Lymphome sind Gewebeneubildungen (= lymphatische Neoplasien), die zum Zeitpunkt der Erstdiagnose auf das zentrale Nervensystem (ZNS), insbesondere das Gehirn und das Nervenwasser, begrenzt sind. Die meist sehr aggressiven Lymphome können durch Therapien mit Zytostatika, die die Blut-Hirn-Schranke passieren, oder durch Ganzhirnbestrahlung manchmal über mehrere Jahre zurückgedrängt werden. In einigen Fällen gelingt sogar eine Heilung. Allerdings spricht etwa ein Viertel der Patienten auf die primäre Therapie nicht an und mehr als die Hälfte erleidet ein Rezidiv.
Für diese erfolglos vorbehandelten Patienten haben Ärzte und Wissenschaftler der Deutschen Studiengruppe für Primäre ZNS-Lymphome (G-PCNSL-SG) mit Sitz an der Charité Berlin eine Phase-II-Studie mit dem Wirkstoff Temsirolimus als Monotherapie durchgeführt. Das zielgerichtete Medikament, das bereits bei anderen rezidivierten Lymphomen eine Wirksamkeit bei tolerablen Nebenwirkungen zeigte, hemmt den mTOR-Signalweg und blockiert damit einen Mechanismus, der für das Überleben der Tumorzellen wichtig ist.
„Aufgrund seines Wirkprofils und der Hinweise darauf, dass Temsirolimus in der Lage ist, die Blut-Hirn-Schranke zu passieren, wollten wir die Wirksamkeit dieses Medikaments auch bei Patienten mit primären ZNS-Lymphomen (PZNSL) untersuchen“, erläutert Dr. Agnieszka Korfel, Oberärztin der Klinik für Hämatologie, Onkologie und Tumorimmunologie der Charité und Leiterin dieser klinischen Prüfung die Studienergebnisse. „Bei dieser ersten abgeschlossenen prospektiven Studie mit einem zielgerichteten Medikament beim PZNSL zeigte sich, dass die Substanz beim rezidivierten ZNS-Lymphom erstaunlich aktiv ist, bei unserem Patientenkollektiv allerdings mit einer nicht unerheblichen Toxizität einherging“, erläutert die Ärztin und Wissenschaftlerin die Ergebnisse.
In die Studie waren nur Patienten eingeschlossen worden, bei denen die Krankheit nach teilweise mehreren Vortherapien weiter fortgeschritten bzw. zurückgekehrt war, darunter auch sieben Patienten, die eine Hochdosistherapie mit autologer Stammzelltransplantation erhalten hatten. Im Rahmen der Studie bekamen die Patienten einmal pro Woche intravenös entweder 25 mg (die ersten sechs Patienten) oder 75 mg (alle weiteren Patienten) Temsirolimus über einen Zeitraum von maximal 12 Monaten.
Von den insgesamt 37 Patienten sprachen 20 Patienten auf die Therapie an (ORR = 54 % [95% CI 37%-71%]), bei einigen Patienten (n=6, 16%) hielt die Remission über einen Zeitraum von mehr als fünf Monaten an. Allerdings ließ sich das Ansprechen nicht für alle Patienten in ein vergleichsweise längeres progressionsfreies Überleben (PFS) übertragen: Das mediane PFS betrug insgesamt 2,1 Monate (95% CI 1,1-3,0) bei einem 1-Jahres PFS von 5,4 % [95% CI >0-11,2]. Das mediane Gesamtüberleben (OS) lag bei 3,7 Monaten [95% CI 1,5-5,8] mit einem 1-Jahres OS von 19% [95 CI 6,1-37,7] sowie einem 2-Jahres OS von 16,2 % [95% CI 4,1-28,4]. Nicht zu vernachlässigen war das Nebenwirkungsspektrum von Temsirolimus: Die häufigsten höhergradigen Toxizitäten waren die Erhöhung des Blutzuckers (29,7 %), Thrombozytopenien (21,6 %), Infektionen (19 %), Anämien (10,8 %) und Hautausschlag (8,1 %).
„Wir gehen davon aus, dass die Tumorzellen rasche Resistenzen gegen den Wirkstoff entwickelt haben, so dass die feststellbare Aktivität nicht von langer Dauer war“, interpretiert Korfel die Ergebnisse. „Zukünftig erscheint es uns deshalb sinnvoll, Temsirolimus in Kombination mit Zytostatika oder mit Rituximab und bereits in früheren Therapielinien einzusetzen“, umreißt die Ärztin Perspektiven für künftige Therapiestudien. „Vor dem Hintergrund der Toxizität des Wirkstoffs sollte dies vor allem jüngeren und fitten Patienten angeboten werden und mit einer prophylaktischen Antibiose einhergehen“, fügt sie hinzu.
Die Originalarbeit ist am 13.03.2016 unter dem Titel „Phase II trial of temsirolimus for relapsed/refractory primary central nervous system lymphome (PCNSL)“ im Journal of Clinical Oncology erschienen und kann unter folgendem Link abgerufen werden: http://jco.ascopubs.org/cgi/doi/10.1200/JCO.2015.64.9897
Quelle: Kompetenznetz Maligne Lymphome e.V. (KML)
Internet: www.lymphome.de
Schmerztherapie – Neuer Wirkstoff Oxytocin doppelt wirksam gegen Schmerz
Wissenschaftler aus der Schaller-Forschungsgruppe “Neuropeptide” (Deutsches Krebsforschungszentrum, CellNetworks und ZI Mannheim) identifizierten im Gehirn ein “Schmerz-Kontrollzentrum”. Dort kooperieren zwei verschiedene Typen Oxytocin-produzierender Nervenzellen und unterdrücken so den Schmerz gleich doppelt: Oxytocin blockiert die Weiterleitung von Schmerzreizen im Rückenmark und hemmt gleichzeitig die Schmerzempfindung in der Körperperipherie.
“Kuschelhormon” und Neurotransmitter: Das Neuropetid Oxytocin kann beide Rollen spielen: Als Hormon wirkt es im Körper und löst etwa Wehen aus oder leitet den Milchfluss ein. Im Gehirn wirkt Oxytocin als Botenstoff zwischen Nervenzellen, dämpft Ängste und beeinflusst das menschliche Sozialverhalten positiv. Seit kurzem vermuten Wissenschaftler auch, dass es als körpereigene Schmerzbremse wirkt.
Im Hypothalamus, dem wichtigstem Steuerzentrum des vegetativen Nervensystems, produzieren zwei verschiedene Arten von Nervenzellen Oxytocin. Die sogenannten großzelligen (“magnozellulären”) Oxytocin-Neuronen speisen das Neuropeptid über die Hirnanhangdrüse in die Blutbahn ein und versorgen so den Körper mit dem Hormon. Die Aufgabe der kleinzelligen (“parvozellulären”) Oxytocin-Neuronen war noch nicht genau verstanden.
Wissenschaftler um Valery Grinevich entdeckten nun an Ratten einen Bereich im Hypothalamus, der als Schmerz-Kontrollzentrum funktioniert. Nur etwa 30 parvozelluläre Oxytocin-produzierenden Nervenzellen orchestrieren dort die schmerzhemmende Wirkung des Neuropeptids. Grinevich leitet die Schaller Forschungsgruppe “Neuropeptide”, die am Deutschen Krebsforschungszentrum (DKFZ), am Exzellenzcluster CellNetworks der Universität Heidelberg und am ZI Mannheim angesiedelt ist. Er koordinierte das internationale Forschungsprojekt gemeinsam mit Kollegen aus Frankreich und der Schweiz.
Die kleine Gruppe der neu entdeckten Neuronen treten bei akuten Schmerzen oder Entzündungen in Aktion: Unter diesen Bedingungen aktivieren sie die magnozellulären Oxytocin-produzierenden Neuronen im benachbarten “supraoptischen Nukleus” des Hypothalamus. Das löst die die Oxytocin-Ausschüttung in die Blutbahnen aus und lindert dadurch diffus die Schmerzempfindung, die über entsprechende periphere Nervenzellen vermittelt wird.
Auf der anderen Seite reichen die Neuronen des Schmerz-Kontrollzentrums mit langen Ausläufern bis in tiefe Schichten des Rückenmarks. Dort speisen sie das Neuropeptid exakt an der Stelle des Zentralnervensystems ein, wo die Intensität der Schmerzwahrnehmung weitergeleitet wird.
Die neu entdeckten Neuronen hemmen den Schmerz also auf doppelte Weise: Ein schneller schmerstillender Effekt entsteht durch Filtern des Schmerzreizes im Zentralnervensystem. Etwas länger dauert es, bis das ins Blut ausgeschüttete Oxytocin die Schmerzempfindung lindert.
“Wir haben hier erstmals gezeigt, dass zwei anatomisch unterschiedliche Neuronentypen funktionell kooperieren müssen, um die Oxytocin-Wirkung zu steuern, sagt der Valery Grinevich. Oxytocin wird wegen seiner positiven Wirkung auf das Sozialverhalten bereits seit längerem als Medikament gegen bestimmte Symptome von Autismus oder Schizophrenie diskutiert. “Von jetzt an sollten wir auch darüber nachdenken, wie sich Oxytocin als Schmerzstiller therapeutisch einsetzten lässt”, kommentiert Grinevich seine aktuellen Ergebnisse.
Quelle: Deutschen Krebsforschungszentrums, des Zentralinstituts für Seelische Gesundheit und des Exzellenzclusters CellNetworks
Literaturhinweis:
Marina Eliava, Meggane Melchior, H. Sophie Knobloch-Bollmann, Jérôme Wahis, Miriam da Silva Gouveia, Yan Tang, Alexandru Cristian Ciobanu, Rodrigo Triana del Rio, Lena C. Roth, Ferdinand Althammer, Virginie Chavant, Yannick Goumon, Tim Gruber, Nathalie Petit-Demoulière, Marta Busnelli, Bice Chini, Linette L. Tan, Mariela Mitre, Robert C. Froemke, Moses V. Chao, Günter Giese, Rolf Sprengel, Rohini Kuner, Pierrick Poisbeau, Peter H. Seeburg, Ron Stoop, Alexandre Charlet, and Valery Grinevich: A new population of parvocellular oxytocin neurons controlling magnocellular neuron activity and inflammatory pain processing. NEURON 2016, DOI: 10.1016/j.neuron.2016.01.041
Nieren- und Blasenkrebs: Neuer Therapieansatz in der Immunonkologie erwartet
Eine Tumorerkrankung mit dem eigenen Immunsystem angreifen? Genau dieser Mechanismus wird durch verschiedene neue Substanzen aus dem Bereich der „Immunonkologie“ verfolgt. Im Gegensatz zu herkömmlichen Therapieansätzen, wie der Chemotherapie, bei denen der Tumor direktes Ziel des Wirkstoffes ist, funktionieren die Immunonkologika über eine verstärkte Immunantwort und die daraus resultierende anti-tumoröse Wirkung der körpereigenen Abwehr.
„Dieser Mechanismus greift auch bei urologischen Tumoren und wird die Therapievielfalt beim metastasierten Nierenzellkarzinom und beim metastasierten Harnblasenkarzinom in Kürze erweitern“, sagt Prof. Dr. Christian Wülfing, Pressesprecher der Deutschen Gesellschaft für Urologie e.V. (DGU) angesichts der bevorstehenden Zulassung neuer Wirkstoffe in der uroonkologischen Immuntherapie. Jährlich erkranken laut Statistik des Robert Koch-Instituts in Deutschland rund 15 000 Männer und Frauen neu an Nierenkrebs und etwa 29 000 an Blasenkrebs.
 Prof. Dr. Christian Wülfing, Urologie, Asklepios Klinik Altona
Prof. Dr. Christian Wülfing, Urologie, Asklepios Klinik Altona
Schlüssel für den Fortschritt im Kampf gegen Krebs sind die „T-Zellen“. Prof. Wülfing: „Die körpereigenen zytotoxischen T-Zellen, die in der Lage sind, körperfremde Zellen – auch Tumorzellen – zu erkennen und zu zerstören, werden durch ein komplexes Zusammenspiel bestimmter aktivierender und hemmender Signale gesteuert. Diese sogenannten Immun-Checkpoints steuern die Zerstörung von fremden Zellen, verhindern dabei aber eine dauerhafte Immunantwort und somit eine Schädigung gesunden Gewebes. Die wichtigsten Regulatoren in diesem Zusammenspiel sind die PD-1-/PD-L1- und die CTLA-4 Signalwege, die in den letzten Jahren in den Fokus der pharmakologisch-onkologischen Forschung kamen.“ Verschiedene neue Wirkstoffe, die diese Signalwege anzielen, konnten synthetisiert und in klinische Studien eingebracht werden.
Zwei dieser neuen Substanzen zeigen in aktuellen Studien ein deutlich verlängertes Überleben für Patienten mit metastasiertem Nierenzellkarzinom (mNZK) und für Patienten mit metastasiertem Harnblasenkarzinom. Der Wirkstoff Nivolumab wurde in einer randomisierten Phase-III Studie zur Zweitlinientherapie des mNZK (Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma, Robert J. Motzer et al.) getestet. Insgesamt 821 Patienten wurden in den Nivolumab- oder Everolimus-Therapiearm randomisiert. Es fand sich ein Gesamtüberleben von 25,0 versus 19,6 Monaten, was einer 23%igen Verringerung des Sterberisikos entsprach.
Beim metastasierten Harnblasenkarzinom wurde die Substanz Atezolizumab in einer Phase-II Studie getestet, die zuletzt im Januar 2016 in San Francisco vorgestellt wurde (IMvigor 210, a phase II trial of atezolizumab (MPDL3280A) in platinum-treated locally advanced or metastatic urothelial carcinoma (mUC)). Hier konnten 310 Patienten eingeschlossen und im Sinne einer Zweitlinientherapie nach Cisplatin-Therapieversagen behandelt werden. Abhängig von der PD-L1-Expression im Tumorgewebe konnte ein objektives Ansprechen in bis zu 26% und ein Überleben von bis zu 11.4 Monaten erzielt werden.
„Erfreulicherweise gingen die Behandlungen mit diesen innovativen Substanzen insgesamt mit einem sehr günstigen Toxizitätsprofil einher“, sagt der DGU-Pressesprecher. So scheinen die Wirkstoffe nur sehr selten höhergradige Nebenwirkungen auszulösen. Selten scheint auch mit immunvermittelten Nebenwirkungen wie Durchfall und Bauchkrämpfen oder Störungen der Hormonproduktion und -regulation zu rechnen zu sein, deren Behandlung, laut Prof. Wülfing, geschult erfolgen müsse.
Während Atezolizumab zunächst in einem klinischen Studienprogramm weiter verfolgt und derzeit in einer Phase-III Studie zur unterstützenden Therapie nach Entfernung der Harnblase (adjuvante Therapie) getestet wird, ist der klinische Einsatz von Nivolumab zur Immuntherapie beim metastasierten Nierenzellkarzinom in Deutschland in Kürze zu erwarten. Prof. Wülfing: „Nachdem die amerikanische Zulassungsbehörde FDA aufgrund der dargestellten Studienergebnisse Nivolumab Ende 2015 die Marktfreigabe für die Indikation fortgeschrittenes Nierenzellkarzinom erteilt hat, ist in den nächsten Monaten mit der europäischen Zulassung zu rechnen.“ Ein wichtiger Schritt dahin ist getan: Aktuell hat der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur (EMA) die Indikationserweiterung empfohlen. Die Empfehlung wird nun von der Europäischen Kommission, die über die Zulassung von Arzneimitteln in den Mitgliedsstaaten entscheidet, geprüft. Nivolumab ist bereits bei metastasiertem Lungen- und Hautkrebs zugelassen.
„Im nächsten Schritt geht es um die Frage nach der besten Therapiesequenz in der Uroonkologie, das heißt der individuell optimalen Anwendung des neuen Wirkstoffs“, sagt DGU- und Kongresspräsident Prof. Dr. Kurt Miller und verweist auf den 68. Kongress der Deutschen Gesellschaft für Urologie e.V. vom 28. September bis 1. Oktober 2016 in Leipzig, wo die Immuntherapie des mNZK zu den vielversprechendsten wissenschaftlichen Themen zählt.
Quelle: Deutsche Gesellschaft für Urologie (DGU e.V.)
TOP-Infos zu modernen Krebsmedikamenten: Arzneimittel bewertung wird neue Rubrik auf Onkopedia.com
 Prof. Dr. Diana Lüftner, Oberärztin an der Medizinischen Klinik mit Schwerpunkt Hämatologie und Onkologie an der Berliner Charité.
Prof. Dr. Diana Lüftner, Oberärztin an der Medizinischen Klinik mit Schwerpunkt Hämatologie und Onkologie an der Berliner Charité.Genetisches Profiling – In der Krebsmedizin ist die genetische Diagnostik mittlerweile unverzichtbar
Anlässlich des 32. Deutschen Krebskongresses 2016 in dessen Rahmen am 27. Februar auch der Krebsaktionstag für Laien und Betroffene angeboten wird, hat die Deutsche Krebsgesellschaft e.V. und die Deutsche Krebshilfe gemeinsam mit der Berliner Krebsgesellschaft drei Referenten interviewt, die wir hier ungekürzt veröffentlichen möchten.
Noch vor wenigen Jahren war die DNA-Sequenzierung ausschließlich ein Werkzeug der Grundlagenforscher zur Entschlüsselung des genetischen Codes. Mittlerweile hat diese Technik Einzug in die Klinik gehalten. Denn Genmutationen, die man im Tumor findet, können wertvolle Informationen für die gezielte Therapieauswahl liefern.
Prof. Dr. Christoph Röcken, Sprecher der Arbeitsgemeinschaft Onkologische Pathologie in der Deutschen Krebsgesellschaft, erklärt im Interview, wie ein genetisches Tumorprofil erstellt wird und beschreibt die Herausforderungen.
Herr Professor Röcken, können Sie Beispiele nennen, wo eine Genveränderung im Erbgut des Tumors heute schon den Weg zur gezielten Therapie weist?
Das gilt mittlerweile beim Dickdarmkrebs, beim Lungenkrebs, beim schwarzen Hautkrebs, bei Hirntumoren und seit 2015 auch beim Eierstockkrebs. Bei diesen Krebsarten erhalten Pathologen häufig den Auftrag, herauszufinden, ob der Tumor bestimmte Mutationen trägt.
Wie wird das Ausgangsmaterial für die Analyse gewonnen?
Wir starten mit Biopsiematerial oder mit Tumorgewebe aus einer OP und fertigen daraus zunächst Gewebeschnitte an. Anschließend grenzen wir unter dem Mikroskop das Tumorareal ein und berücksichtigen dabei die Heterogenität des Tumors. Die fraglichen Areale werden gezielt herauspräpariert (mikrodisseziert), man gewinnt daraus die DNA und untersucht sie anschließend mit einer DNA-Sequenzierung auf Mutationen.
Welche Sequenzierungsmethoden kommen dabei zum Einsatz?
In der diagnostischen Routine geht es häufig um die Frage, ob ein bestimmtes Gen eine bestimmte Mutation trägt. D.h. der entsprechende Gen-Abschnitt wird zunächst vervielfältigt und dann einer klassischen Sanger-Sequenzierung unterzogen. Mittlerweile sind aber viele Gene bekannt, die in der Diagnostik und Therapie eine Bedeutung haben. Will man die alle mit der klassischen Methode überprüfen, muss man jedes Gen einzeln sequenzieren – ein enormer Zeitaufwand. Das Next Generation Sequencing, kurz NGS, erlaubt die parallele Sequenzierung vieler Gene. Damit lassen sich z. B. 10 bis 40 Gene auf einmal untersuchen, und zwar in einer sogenannten Panel-Sequenzierung. Das steigert die Effizienz der Sequenzierung enorm.
Mit sogenannten Liquid Biopsies wollen die Experten mittlerweile auch im Blut nach der mutierten Krebs-DNA suchen. Wie zuverlässig ist diese Diagnostik?
Dass Tumor-DNA oder auch Tumorzellen im Blut vorkommen, weiß man schon länger. Hämatologen nutzen das bei bestimmten Leukämien, und zwar zur Bestimmung der Resterkrankung nach der Therapie. Diese Leukämien tragen eine charakteristische Mutation; je geringer die Konzentration an mutierter DNA im Blut, desto geringer die minimale Resterkrankung. Auch solide Tumoren können beim Untergang von Tumorzellen DNA ins Blut freisetzen. Das gilt allerdings nicht für alle Tumorarten in jedem Tumorstadium. Annähernd 100% der Patienten mit fortgeschrittenem Darmkrebs weisen zirkulierende Tumor-DNA im Blut auf, nur 40% beim Prostata- oder Nierenkarzinom, und beim Hirntumor findet man gar keine Tumor-DNA im Blut.
Gibt es noch weitere Einschränkungen?
Man muss die Mutation, nach der gesucht werden soll, genau kennen. Eine Liquid Biopsy zur Suche nach einer Genveränderung, die der Tumor gar nicht trägt, macht keinen Sinn. An der Erstellung eines genetischen Profils des Tumors kommt man also nicht vorbei. Außerdem kommen einige der Mutationen, die wir in bösartigen Tumoren finden, auch bei gutartigen Tumoren vor. Insgesamt ist also noch einiges an Standardisierung und Qualitätssicherung nötig, bevor die Liquid Biopsy bei Patienten mit soliden Tumoren routinemäßig angewendet werden kann. Zur Überprüfung des Therapieansprechens bei Patienten mit einer hohen Tumorlast könnten Liquid Biopsies aber durchaus nützlich sein.
Was verändert sich durch die genetische Diagnostik in der Pathologie?
Für die Einteilung von Tumoren ist sie mittlerweile unverzichtbar und ich sehe darin eine große Chance, um die Therapie noch genauer auf die Biologie des Tumors abstimmen zu können. Natürlich unterliegt diese Art der Diagnostik einer großen Dynamik, und wir sind gefordert, mit dem raschen Zuwachs an Wissen und der Entwicklung neuer Methoden Schritt zu halten. Deshalb sind Kongresse wie der DKK 2016 wichtig, bei dem die Experten zusammenkommen, um ihr Wissen auszutauschen. Vor allem im translationalen Programmteil des DKK 2016 sind die Themen Molecular Diagnostics, Next Generation Sequencing und Liquid Biopsy vertreten. Ich verspreche mir interessante Beiträge und spannende Sitzungen vom DKK 2016.
Quelle: Deutsche Krebsgesellschaft, Deutsche Krebshilfe
Ein bösartiges Netzwerk macht Hirntumoren resistent gegen Therapie
Glioblastome sind die bösartigsten unter den Hirntumoren. Ärzte und Wissenschaftler unter Federführung der Klinischen Kooperationseinheit Neuroonkologie des Deutschen Krebsforschungszentrums und des Universitätsklinikum Heidelberg beschreiben nun in der Zeitschrift Nature, dass die Glioblastomzellen untereinander durch lange Zellfortsätze verbunden sind. Die Krebszellen kommunizieren über diese Verschaltung und schützen sich dadurch vor therapiebedingten Schäden. Blockierten die Forscher die Netzwerk-Bildung, so drangen die Krebszellen weniger invasiv in das Gehirn ein und sprachen besser auf die Strahlenbehandlung an.
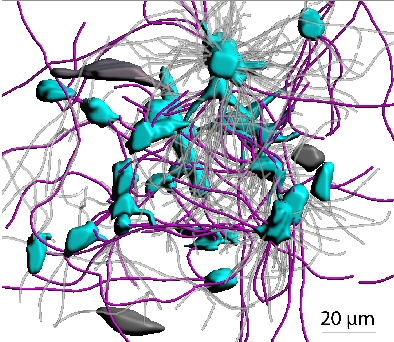
Hirntumoren aus der Gruppe der unheilbaren Astrozytome, zu denen auch die besonders bösartigen Glioblastome zählen, wachsen wie ein Pilzmyzel diffus in das gesunde Gehirn ein. Daher lassen sie sich durch eine Operation nicht vollständig entfernen und wachsen trotz intensiver Therapie weiter – sie besitzen offenbar wirksame Resistenzmechanismen.
Wissenschaftler um Frank Winkler von der Neurologischen Universitätsklinik Heidelberg und vom Deutschen Krebsforschungszentrum beschreiben in ihrer aktuellen Arbeit eine verblüffende Eigenschaft der Astrozytomzellen: Sie bilden extrem dünne und lange Fortsätze ihrer Zellmembran aus, mit denen sie das gesunde Gehirn durchdringen, es ständig abtasten, und schließlich kolonisieren.
Mit zunehmendem Tumorwachstum verbinden sich die Krebszellen mit diesen Fortsätzen zu einem großen Netzwerk. In diesem Netzwerk kommunizieren sie so intensiv über so lange Distanzen, dass man Astrozytome als hochkomplexe, organähnliche Strukturen verstehen kann. „Unser erster Gedanke war: das sieht ja aus wie die Neubildung eines Gehirns im bestehenden Gehirn”, berichtet Frank Winkler. „Die Tumorzellen waren stark untereinander vernetzt, so wie wir das von Nervenzellen im Gehirn kennen.“
Die Forscher beobachteten bis über ein Jahr hinweg das Wachstum menschlicher Glioblastome, die sie auf Mäuse übertragen hatten. Sie nutzten dazu eine spezielle Mikroskopietechnik, die Einblicke in tiefe Zonen des Gehirns ermöglicht. So fanden sie heraus, dass die Tumorzellen Moleküle über die Membranschläuche austauschten und sie darüber hinaus als Kommunikationskanäle nutzen.
Auch im Gewebe von Hirntumor-Patienten entdeckten die Forscher das Netzwerk aus Membranfortsätzen. Je vernetzter die Krebszellen waren, desto bösartiger und resistenter war der Hirntumor-Typ.
Die Wissenschaftler vermuteten daher rasch, dass die Netzwerke aus Membranfortsätzen mit der Therapieresistenz im Zusammenhang stehen müssen. Tatsächlich erkennen die Tumore eine Schädigung des Netzwerks und reparieren es umgehend. Eine Bestrahlung – die Standardtherapie beim Glioblastom – überleben vor allem diejenigen Tumorzellen, die Teil des Netzwerkes sind, unvernetzte Krebszellen dagegen sterben.
Wie kommen die Tumorzellen zu ihren ungewöhnlichen Membranfortsätzen? Einen Hinweis darauf ergab die Analyse der Genaktivitäten von 250 Hirntumorpatienten. Die Krebszellen missbrauchen bestimmte molekulare Signalwege, die normalerweise an der frühen Entwicklung des Nervensystems beteiligt sind, für ihre Vernetzung. Nach einer experimentellen Blockade dieser Signalwege entwickelten die Mäuse geringer vernetzte kleinere Tumoren, die sehr stark auf Strahlentherapie ansprachen.
„Die Resistenz der Astrozytome, insbesondere der Glioblastome, gegen alle Therapieformen ist ein enormes Problem. Unsere Ergebnisse zeigen uns erstmals einen lang gesuchten neuen Ansatz auf, diese Resistenz zu brechen, um die Tumoren zukünftig möglicherweise besser behandeln zu können. Zudem zeigen die Ergebnisse, warum eine molekular definierte Subgruppe von Hirntumoren deutlich stärker von der Therapie profitiert. Bei ihnen scheint die Möglichkeit zur Netzwerkbildung begrenzt zu sein“, sagt Wolfgang Wick, Leiter der Klinischen Kooperationseinheit und der Neurologischen Universitätsklinik Heidelberg.
Matthias Osswald, der Erstautor der Arbeit, ergänzt: „Auch wenn wir mit dieser Entdeckung unseren Hirntumorpatienten noch nicht unmittelbar helfen können, wissen wir doch zumindest, in welche Richtung künftige Therapien entwickelt werden sollten: Wir müssen das bösartige Netzwerk zerstören.”
Autoren des Artikels:
Matthias Osswald, Erik Jung, Felix Sahm, Gergely Solecki, Varun Venkataramani, Jonas Blaes, Sophie Weil, Heinz Horstmann, Benedikt Wiestler, Mustafa Syed, Lulu Huang, Miriam Ratliff, Kianush Karimian Jazi, Felix T. Kurz, Torsten Schmenger, Dieter Lemke, Miriam Gömmel, Martin Pauli, Yunxiang Liao, Peter Häring, Stefan Pusch, Verena Herl, Christian Steinhäuser, Damir Krunic, Mostafa Jarahian, Hrvoje Miletic, Anna S. Berghoff, Oliver Griesbeck, Georgios Kalamakis, Olga Garaschuk, Matthias Preusser, Samuel Weiss, Haikun Liu, Sabine Heiland, Michael Platten, Peter E. Huber, Thomas Kuner, Andreas von Deimling, Wolfgang Wick und Frank Winkler: Brain tumor cells interconnect to a functional and resistant network. Nature 2015, DOI: 10.1038/nature16071
Quelle: Deutsches Krebsforschungszentrum, Heidelberg
Immuntherapie in der Onkologie – neue Standards und zukünftige Strategien
Das Immunsystem stärken, um den Krebs zu bekämpfen. Das ist seit langem der Wunsch vieler Patientinnen und Patienten sowie Krebstherapeuten. Genährt wird diese Hoffnung aus Einzelfallbeobachtungen eines spontanen Tumorrückgangs, sowie durch therapeutische Erfolge mit immunstimulierenden Medikamenten insbesondere beim malignen Melanom, dem schwarzen Hautkrebs, sowie dem Nierenzellkarzinom. Frühe immunaktivierende Therapien mit Interferon und Interleukin-2 in den 1980er Jahren waren sehr nebenwirkungsreich. Die Behandlung mußte meist stationär auf einer Überwachungseinheit durchgeführt werden. Ein Langzeit-Therapieerfolg war nur bei einzelnen Patienten zu verzeichnen.
Die Frage war, wie Tumoren es schaffen sich vor dem Immunsystem zu verstecken oder es ruhigzustellen. Die Forschung der letzten Jahrzehnte hat einige dieser Mechanismen aufgedeckt und daraus neue Immuntherapien für Tumoren abgeleitet.
T-Zellen sind die „Polizisten“ des Immunsystems. Sie werden durch eine Vielzahl an Signalen ruhiggestellt oder auch aktiviert. Dies geschieht an sogenannten Immun-Kontrollpunkten (Checkpoints). Hier können Tumorzellen regulierend eingreifen, um sich vor dem Zugriff des Immunsystems zu schützen. Der CTLA-4 (anti–cytotoxic T-lymphocyte– associated antigen 4) und der PD-1 (programmed cell death protein 1)-Signalweg sind dafür von zentraler Bedeutung. Gegen beide Stoffwechselwege wurden blockierende Antikörper entwickelt. Dadurch werden die schlafenden T-Zell-„Polizisten“ wieder aufgeweckt und gegen den Tumor in Marsch gesetzt.
In einem Symposium des Nationalen Centrums für Tumorerkrankungen in Heidelberg wurden im Februar 2015 die seit kurzem zugelassenen und die noch in klinischen Studien befindlichen Therapieansätze der Modulation von Immun-Kontrollpunkten für verschiedene häufige Tumorarten beleuchtet.
Malignes Melanom
Antikörper-basierte immunaktivierende Therapien mit CTLA-4 und PD-1 als Zielstrukturen haben in kurzer Zeit aufgrund der beeindruckenden Erfolge eine breite Anwendung gefunden. Inzwischen liegen beim Malignen Melanom für den CTLA-4 Antikörper Ipilimumab Erfahrungen mit mehr als 5000 Patienten aus den klinischen Studien und dem Markteinführungsprogramm vor.
Erstmals wurde mit Ipilimumab beim metastasierten Melanom in 20% der Patienten ein stabiles Langzeitüberleben nach 3 Jahren beobachtet. So gute Zahlen lassen sich auch nicht mit den neuen für BRAF-mutierte Melanome zugelassene Tyrosinkinaseinhibitoren (TKI) erzielen. Als neue Zielstruktur ist nun PD-1 hinzugekommen. Nivolumab ist ein PD-1 Antikörper mit dem die meisten Erfahrungen vorliegen. Er wird allein und in Kombination eingesetzt.
Im Jahr 2013 berichtete die Studiengruppe um Wolchok ihre Erfahrungen einer Kombination der anti-CTLA-4 und anti-PD-1 Antikörper. Sie konnten beim metastasierten Melanom ein Überleben von 88% der Patienten nach zwei Jahren berichten.
Beim metastasierten malignen Melanom kann –wie von Alexander Enk (Heidelberg) dargestellt- mit dem PD-1 Antikörper Nivolumab allein eine mittlere 2-Jahres-Überlebensrate von 42% erzielt werden.
Dies ist mehr als durch die bisher verfügbaren Ansätze mit dem Tyrosinkinase-Inhibitor (TKI) Vemurafenib, mit dem CTLA-4 Antikörper Ipilimumab oder einer Chemotherapie erreicht werden kann. Das war noch vor kurzem ein nicht erreichbar scheinendes Ziel. Die Therapie erfolgte dabei ambulant und ist unaufwendig. Die Nebenwirkungen können allerdings gravierend sein und es braucht einen erfahrenen Onkologen, um damit sicher umgehen zu können. Häufig kommt es durch die Immunaktivierung und den Kampf der Immunzellen gegen den Tumor in der Bildgebung zunächst zu einer Größenzunahme, einer Pseudoprogression, bevor eine Regression eintritt. Deshalb sollte das objektive Therapieansprechen erst nach 6-8 Wochen beurteilt werden. Interessant ist auch, dass bei einer Tumorzunahme eine nochmalige Gabe einer solchen immunstimulierenden Therapie wieder wirksam sein kann.
Tumoren, die besonders gut ansprechen sind solche mit einer hohen Zahl an Erbgutveränderungen im Tumor, das heißt hohen Mutationsraten. Die Tumorzellen unterscheiden sich dadurch stärker von den normalen Körperzellen und sind deshalb für das Immunsystem leichter erkennbar.
Im April 2015 gab die Europäische Arzneimittelbehörde EMA deshalb ein positives Votum für die Zulassung von Nivolumab für die Behandlung des fortgeschrittenen Malignen Melanoms.
Lungenkrebs / Bronchialkarzinom
Die Rolle der neuen Immunaktivatoren beim Lungenkarzinom wurde ausführlich von Helge Bischoff (Heidelberg) beleuchtet. Die Wirksamkeit des CTLA-4 Antikörpers Ipilimumab beim Bronchialkarzinom wurde bereits 2012 von einer internationalen Studiengruppe gezeigt und inzwischen an einer größeren deutschen Patientengruppe 2013 bestätigt.
Der PD1 Antikörper Nivolumab wurde von der Gruppe um Brahmer eingesetzt und zeigte beim Plattenepithelkarzinom in der Check-Mate 017 Studie ein 1-Jahres Überleben von 42% in der ersten Studien und in der CA209-003 Studie eine mediane Response-Dauer von 75 Wochen. Die Überlebenszeit liegt damit fast doppelt so hoch wie es mit einer konventionellen Chemotherapie mit Docetaxel bisher erreichbar war. Diese Daten veranlassten die Europäische Arzneimittelbehörde zu einem positiven Votum für Nivolumab. Eine Zulassung für die Therapie fortgeschrittener oder metastasierter Plattenepithel-Bronchialkarzinome nach Chemotherapie-Vorbehandlung ist im Juli 2015 erfolgt.
Auch mit dem PD1-Ligand Antikörper Pembrolizumab wurde von Garon und Mitarbeitern auf der Jahrestagung der amerikanischen Gesellschaft für Onkologie für das Adeno-Bronchialkarzinom ein Gesamtüberleben von 40%-80% berichtet. Dies war abhängig von der PD1 Expression im Tumor.
Mit dem PD1-Ligand Antikörper MPDL3280A, wurde -unabhängig ob es sich um ein nicht-kleinzelliges Bronchialkarzinom mit Plattenepithel- oder Adenokarzinom-Histologie handelte- eine Ansprechrate von 85% beobachtet. Nach 6 Monaten betrug das progressionsfreie Überleben 45%. Die besten Ansprechraten fanden sich auch hier bei der höchsten PD1-Ligand-Expression.
Nierenzellkarzinom
Interessante Daten zu urologischen Tumoren wurden von Carsten Grüllich (Heidelberg) vorgestellt. Der PD1-Antikörper Nivolumab erzielte in der CA209-010 Studie beim metastasierten Nierenzellkarzinom ein 2-Jahres-Überleben von 50%, sowie ein Langzeitansprechen bei 20%. Dies unterschied sich von einer Ansprechrate von 22% bei Patienten mit hoher PD1-Expression im Tumor zu 8% bei solchen mit niedriger Expression. Mit einem Gesamtüberleben von im Mittel 25 Monaten sind die Ergebnisse mit dem immunstimulierenden Antikörper besser als die in den AXIS, RECORD-1 und weiteren Untersuchungen veröffentlichten Ergebnisse mit Tyrosinkinaseinhibitoren beim Nierenzellkarzinom. Die Kombination von Nivolumab und Ipilimumab in der Ca209-016 Studie zeigte ein Ansprechen mit anhaltender Wirksamkeit in 80% der Patienten und ein Überleben von 65% nach zwei Jahren. Immerhin setzen aufgrund der Nebenwirkungen 30% der Patienten die Therapie ab. Selbst bei diesen fand sich in 45% noch ein anhaltendes Tumoransprechen. Dies legt nahe, dass bereits eine einmalige Aktivierung des Immunsystems ausreichen könnte, um wieder die Kontrolle über den Tumor zu gewinnen. Phase-III Studien in der ersten Therapielinie sind beim metastasierten Nierenzellkarzinom geplant. Auf der Basis vorliegender Daten wird zunächst voraussichtlich eine Zulassung immunstimulierender Antikörper nach Versagen von Tyrosinkinaseinhibitoren beantragt.
Die simultane Kombination von Nivolumab mit den für das Nierenzellkarzinom zugelassenenen TKI Sunitinib oder Pazopanib war in der CA209-016 Studie zwar sehr gut wirksam. In 70% bis 80% der Patienten traten jedoch höhergradige Nebenwirkungen auf. Dabei handelte es sich vorwiegend um TKI-typische Nebenwirkungen. Als Weiterentwicklung werden innovative Ansätze wie z.B. sequentielle Therapien geprüft.
Beim Prostatakarzinom ist die Wirksamkeit immunstimulierender Antikörper bisher nicht belegt. Eine Studie mit Ipilimumab nach Chemotherapie-Versagen zeigte keinen Benefit für die Patienten. Eine Re-Analyse legte einen möglichen Nutzen für Patienten mit einer niedrig-aggressiven Erkrankung nahe. Weitere Studienbemühungen gehen in diese Richtung.
Morbus Hodgkin
Vielversprechende Ergebnisse bei hämatologischen Neoplasien berichtete Mathias Witzens-Harig (Heidelberg). Der PD1-Blocker Nivolumab zeigte eine gute Wirksamkeit beim rezidivierten Morbus Hodgkin.
Nebenwirkungen
Den Nebenwirkungen der neuen Immuntherapien war ein eigener Vortrag von Guy Ungerechts (Heidelberg) gewidmet. Wie bei klassischen Chemotherapien kommen in 10-20% der Behandlungen höhergradige, Grad 3 oder Grad 4, Nebenwirkungen vor. Diese unterscheiden sich allerdings vom Bekannten. Es werden Hautentzündungen/ Dermatitis, Dickdarmentzündungen mit Durchfällen /Colitis, Leberentzündungen mit entsprechenden Laborveränderungen /Hepatitis, eine Entzündung der Hirnanhangsdrüse /Hypophysitis mit Schilddrüsenunterfunktion beobachtet. Die Dermatitis tritt oft nach 3 Wochen auf und die anderen Nebenwirkungen mit einem Maximum bis Woche 7 nach Therapiebeginn.
Aufgrund von Nebenwirkungen an der Lunge im Sinne einer Pneumonitis ist es erforderlich die Atemfunktion (Diffusionskapazität) bei betroffenen Patienten im Verlauf zu bestimmen.
Hier gilt es aufmerksam zu sein. Es kann eine Suppression des übermäßig aktivierten Immunsystems mit Cortison und je nach Schweregrad zusätzlich Mycophenolat-Mofetil, Infliximab, FK-507 oder Cyclophosphamid erforderlich sein. Hormonmangelerscheinungen durch die Hypophysitis bzw. Hormonüberfunktionen sind zu behandeln.
Immunstimulierende Therapieansätze sind besonders für bisher medikamentös nur schwer angehbare Tumoren wie das Maligne Melanom, das Bronchialkarzinom oder das Nierenzellkarzinom vielsprechend. Bei bestimmten Subgruppen des Mammakarzinoms konnte ebenfalls eine Wirksamkeit nachgewiesen werden, die in Studien weiter charakterisiert wird. Im Gegensatz zu allen anderen medikamentösen Therapien für die genannten Tumoren, erlauben immuntherapeutische Ansätze bei ansprechenden Patienten, eine längerfristige und stabile Krankheitskontrolle.
Das Wichtigste in Kürze
-Neuzulassung eines PD1-Antikörpers für das Maligne Melanom und für das Bronchialkarzinom mit dem Subtyp eines Plattenepithelkarzinoms. Weitere Tumorarten sind in klinischer Prüfung.
-Nebenwirkungen des neuen PD1-gerichteten Immunaktivators sind insgesamt geringer als die Nebenwirkungen einer Standardchemotherapie
Quelle: Prof. Dr. Stefan Frühauf, Herausgeber Krebsmagazin
Klinik Dr. Hancken, Harsefelder Straße 8, 21680 Stade
Immuntherapie bei Lungenkrebs – ASCO 2015
Lungenkrebspatienten, die einen Rückfall erleiden, überleben im Schnitt länger, wenn sie mit einem immunstimulierenden Antikörper behandelt werden, im Vergleich zur bislang üblichen Chemotherapie. Dies ist das Ergebnis einer bahnbrechenden Studie, die jetzt erstmalig auf dem Amerikanischen Krebskongress (ASCO) in Chicago präsentiert wurde. In die Leitung der Studie einbezogen waren das Westdeutsche Tumorzentrum der Medizinischen Fakultät der Universität Duisburg-Essen (UDE) am Universitätsklinikum Essen (UK Essen) und die Abteilung Thorakale Onkologie der Ruhrlandklinik.
Gleichzeitig wurden die Ergebnisse im New England Journal of Medicine veröffentlicht, einer der weltweit renommiertesten medizinischen Fachzeitschriften. Untersucht wurden 272 Patienten, die einen Rückfall eines Plattenepithelkarzinoms der Lunge erlitten hatten. Sie wurden mit dem immunstimulierenden Antikörper Nivolumab behandelt und mit dem bisherigen Standard, einer Chemotherapie mit Docetaxel, verglichen. Die immuntherapeutisch behandelte Patientengruppe hatte eine deutlich längere, mittlere Überlebenszeit.
„Dies ist der erste überzeugende Wirkungsnachweis einer Immuntherapie bei Lungenkrebs“, so Dr. Wilfried Eberhardt, Oberarzt der Inneren Klinik (Tumorforschung). „Wir sind froh, dass wir am Westdeutschen Tumorzentrum zu diesem großen Fortschritt in der Behandlung von metastasiertem Lungenkrebs beitragen konnten.“ Er geht davon aus, dass Lungenkrebs neben dem schwarzen Hautkrebs die zweite Erkrankung ist, bei der die neue Klasse der anti-PD1-Antikörper zur Therapie zugelassen wird. In Chicago wurden weitere Daten präsentiert, die deren Wirksamkeit auch bei anderen Formen von Lungenkrebs demonstrierten.
„Derzeit prüfen wir in klinischen Studien, wie wirksam immunstimulatorische Antikörper bei verschiedenen, fortgeschrittenen Tumorerkrankungen sind“, ergänzt Professor Martin Schuler, Direktor der Inneren Klinik (Tumorforschung). „Wir sind optimistisch, dass künftig viele Krebspatienten von dieser neuen Behandlung profitieren werden.“
Quelle: Beate Kostka M.A. Ressort Presse – Stabsstelle des Rektorats
Universität Duisburg-Essen
Weitere Informationen: Christine Harrell, Tel. 0201/723-1615, christine.harrell@uni-due.de
Weitere Informationen mit Abstract der Studie im New England Journal of medicine:
http://www.nejm.org/doi/full/10.1056/NEJMoa1504627?af=R&rss=currentIssue