Archiv für die Kategorie „Krebserkrankungen“
Molekulardiagnostik in der Krebsmedizin
Die Diagnostik und Therapie maligner Erkrankungen befinden sich in einem tiefgreifenden Wandel. Krebs spaltet sich zunehmend in eine Vielzahl verschiedener Erkrankungen auf, jede mit ganz einzigartigen Merkmalen. Grundlage jeder therapeutischen Maßnahme ist eine differenzierte Diagnostik. Eine zunehmende Rolle spielt in diesem Zusammenhang die Molekulardiagnostik. Ihre Möglichkeiten sind vielfältig, die Analysen komplex, die Erwartungen sehr hoch. Angesichts der Vielfalt der Möglichkeiten und der dynamischen Entwicklung in der Onkologie hat die DGHO Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie e. V. in Kooperation mit weiteren wissenschaftlichen medizinischen Fachgesellschaften ein gemeinsames Positionspapier erarbeitet, das den Einsatz der Molekulardiagnostik in der Versorgung von Patientinnen und Patienten mit Krebs definiert. Gemeinsam mit der Deutschen Krebsgesellschaft und der Deutschen Gesellschaft für Pathologie hat die DGHO das Positionspapier in Berlin vorgestellt.
Indikationsfelder und Beispiele
Prof. Dr. med. Olaf Ortmann, Präsident der Deutschen Krebsgesellschaft (DKG) und Direktor der Klinik für Frauenheilkunde und Geburtshilfe am Caritas-Krankenhaus St. Josef in Regensburg sowie Inhaber des Lehrstuhls für Frauenheilkunde und Geburtshilfe an der Universität Regensburg, machte die Relevanz der stetigen Zunahme der Zahl von molekulardiagnostisch nachgewiesenen, krankheitsbezogenen “Abweichungen von der Norm durch Chromosomenänderung” (Aberrationen) deutlich. “Für den Bereich der Früherkennung und Prävention gilt das beispielsweise für Keimbahnmutationen in den BRCA1- oder BRCA2-Genen, die wir als Risikofaktoren für ein Mamma- oder Ovarialkarzinom kennen. Dabei erlaubt uns der Nachweis und die Charakterisierung krankheitsspezifischer oder -assoziierter Aberrationen eine individuelle Risikoabschätzung und stellt die Basis weiterführender Empfehlungen bzw. Maßnahmen dar.” Im Bereich der Diagnose sind laut Ortmann molekulardiagnostische Verfahren zur Typisierung einer Tumorerkrankung dann indiziert, wenn mit konventionellen gewebediagnostischen Verfahren (zytologische oder histologische, mikroskopische Analysen) keine ausreichende Diagnosesicherung möglich ist, und wenn eine hinreichende Wahrscheinlichkeit besteht, mittels der ergänzenden (molekulargenetischen) Diagnostik eben diese Sicherheit zu erlangen.
Im Bereich der Therapie sind molekulardiagnostische Verfahren dann indiziert, wenn das Ergebnis vorhersagbare (prädiktive) Bedeutung hat, also den Nutzen einer möglichen Therapie vorhersagen kann. Als Beispiel nannte Ortmann das Mammakarzinom: “Mit der Publikation der TAILORx-Studie liegen jetzt erstmals Daten einer großen, prospektiv randomisierten Studie zum prädiktiven Wert einer Genexpressionsanalyse bei Patientinnen mit HR-positivem, nodal negativem Mammakarzinom vor. Auf Basis der TAILORx-Studie kann bei einer definierten Gruppe von Patientinnen mit Hormonrezeptor (HR)-positivem Mammakarzinom die Empfehlung zur adjuvanten Chemotherapie unterstützt, bei einer anderen Gruppe auf die Chemotherapie verzichtet werden”, so der Präsident der DKG.
Durchführung: Klinische Indikation, Ablauf und Interpretation der Ergebnisse
Prof. Dr. med. Carsten Bokemeyer, Vorsitzender der DGHO und Direktor der II. Medizinischen Klinik und Poliklinik für den Bereich Onkologie, Hämatologie und Knochenmarktransplantation mit Sektion Pneumologie am Universitätsklinikum Hamburg-Eppendorf, betonte, dass bei soliden Tumoren und auch bei vielen hämatologischen Neoplasien die Integration der Molekulardiagnostik in den Diagnose-Algorithmus die Auswahl des für den individuellen Patienten besten Therapiekonzeptes erst ermöglicht. Daher muss die molekulare Diagnostik im klinischen Kontext sinnvoll indiziert und interpretiert werden. “Am Ende der Diagnostik steht die interdisziplinäre Diskussion im Tumorboard (Tumorkonferenz) zur Erstellung der Therapieempfehlung für unsere Patientinnen und Patienten. An vielen Zentren sind in den letzten Jahren zudem molekulare Tumorboards mit besonderer Expertise in der Interpretation molekulardiagnostischer Befunde entstanden, die auch überregional zusammenarbeiten”, so Bokemeyer.
Wissen-generierende Versorgung
Durch die Fortschritte der Molekulardiagnostik hat sich die Erkenntnis verstärkt, dass Krebs nicht mehr als eine Krankheit, sondern vielmehr als Sammelbegriff für eine Vielzahl verschiedener Erkrankungen verstanden werden muss, so der Vorsitzende der DGHO. Dabei spaltet sich Krebs zunehmend in eine Vielzahl verschiedener Erkrankungen auf, jede mit definierten, zum Teil einzigartigen Merkmalen. Die mikroskopische Charakterisierung bösartiger Erkrankungen wurde ergänzt um eine komplexe biologische Diagnostik unter Verwendung molekulargenetischer und anderer Verfahren. Das führt vor allem zu einem grundsätzlichen Wandel der Therapie-Algorithmen. Diese Entwicklung ist noch längst nicht abgeschlossen, und die zukünftige Klassifikation von Erkrankungen mit den dazugehörigen Therapieempfehlungen wird auf den Erkenntnissen mit den jetzigen Instrumenten aufbauen. Darüber hinaus muss das individuell gewonnene Wissen aus der Diagnostik und Therapie der Patienten auch der medizinischen Entwicklung in unserer Gesellschaft im Sinne eines aus der Versorgung lernenden Systems zugutekommen. “Auch vor Ort in den jeweiligen Zentren ist ein kontinuierlicher Wissensaustausch zwischen den Diagnostikern und den Therapeuten unerlässlich. Das diagnostische Angebot muss ständig den sich rasch ändernden Anforderungen angepasst werden, zum Beispiel bei der Publikation Therapiestandard-verändernder Studiendaten oder beim Auftreten von Resistenzen unter Therapie mit gezielten Kinase-Inhibitoren”, so Bokemeyer.
Molekulare Testung: Methoden, Qualitätssicherung und die Rolle kommerzieller Anbieter
Prof. Dr. med. Wilko Weichert, Mitglied im Vorstand der Deutschen Gesellschaft für Pathologie (DGP) und Direktor des Instituts für Allgemeine Pathologie und Pathologische Anatomie der Technischen Universität München, verdeutlichte die rasante Entwicklung der molekulargenetischen Untersuchungstechniken in den letzten Jahren – von konventionellen Polymerasekettenreaktionen (PCR) oder Fluoreszenz-In-Situ-Hybridisierung (FISH) bis hin zum Next Generation Sequencing (NGS) mit Analyse des gesamten Exoms (Whole-Exome, WES), des gesamten Genoms (WGS) und des Transkriptoms (RNA-seq). Eine technische Herausforderung ist insbesondere die Analyse der meist kleinen, formalinfixierten, paraffineingebetteten Biopsiepartikel bei fortgeschrittenen Tumorerkrankungen, die einer Operation nicht mehr zugänglich sind. Bezüglich der genannten molekularen Charakterisierungen ist es zum jetzigen Zeitpunkt nicht sinnvoll, eine bestimmte Methode vorzugeben, vielmehr ist das Erreichen eines validen Ergebnisses in der jeweiligen Testung entscheidend. “Erforderlich ist die regelmäßige Durchführung der spezifischen molekulardiagnostischen Analysen und damit eine hohe technische Expertise, die externe Validierung der Analysequalität durch Teilnahme an Qualitätskontrollen in Form von Ringversuchen und eine Akkreditierung beziehungsweise Zertifizierung der Labore”, so Weichert. Dies kann dazu führen, dass nicht jedes Institut für Pathologie und nicht jedes hämatologische Labor eine umfassende Molekulardiagnostik anbieten kann. Aus diesem Grund ist der Auf- und Ausbau kooperativer Strukturen erforderlich, um den Arbeitsablauf und die Einhaltung der Kriterien der Qualitätssicherung zu garantieren.
In diesem Zusammenhang wies das Vorstandsmitglied der DGP auf die etwas kontrovers zu diskutierende Rolle von kommerziellen Anbietern hin, die zurzeit in einigen Bereichen versuchen, Elemente und Strukturen der molekularpathologischen Diagnostik in zentralisierter Form mit einem Fokus auf ökonomische Aspekte zu übernehmen. “Voraussetzung für jedwede Art kommerziell orientierter Molekulardiagnostik ist ihre Integration in den im Positionspapier skizzierten Arbeitsablauf. Dieser beginnt mit der gezielten Indikationsstellung, reicht über die sichere mikroskopische Identifikation von Tumorgewebe und die zielgerichtete Auswahl des korrekten Untersuchungsverfahrens über die qualifizierte Analyse einschließlich der Teilnahme an Qualitätssicherungsmaßnahmen bis zur umfassenden Diskussion der Ergebnisse im Tumorboard. Besonders wichtig erscheint in diesem Zusammenhang auch die volle Integration dieser Diagnostik in lokale beziehungsweise regionale klinisch-onkologische Strukturen, um den integralen Aspekt molekularer Diagnostik im Gesamtkontext der Behandlung nicht zu gefährden”, so Weichert.
Gesundheitspolitische Handlungsfelder
Anhand der Analyse des Ist- und Soll-Zustandes molekularer Diagnostik in der Onkologie sowie angesichts der Fülle diagnostischer und therapeutischer Innovationen ergibt sich auf verschiedenen Ebenen der Gesundheitspolitik Handlungsbedarf. “Wir müssen neben der Sicherstellung der flächendeckenden Verfügbarkeit der molekularen Diagnostik in der Onkologie und der Finanzierung auch die zeitnahe, qualitätsgesicherte Durchführung und die kontinuierliche ärztliche Fortbildung in der Molekulardiagnostik maligner Erkrankungen gewährleisten”, so Prof. Dr. med. Bernhard Wörmann, Medizinischer Leiter der DGHO. Darüber hinaus muss laut Wörmann durch eine kontinuierliche Analyse der Kosten molekularer Diagnostik im ambulanten und stationären Bereich eine Anpassung der Erstattung möglich sein. Außerdem ist die verbindliche Interpretation des Gendiagnostikgesetzes zur Analyse von genetischen Aberrationen notwendig, die gleichzeitig prädiktiv für die individuelle Tumortherapie sind, aber auch Hinweis auf eine hereditäre Belastung für die betroffenen Patientinnen und Patienten und ihre Angehörigen geben können. Des Weiteren gilt es, vor dem Hintergrund einer Patienten-orientierten Abwägung Angebote externer kommerzieller Anbieter gegenüber der Durchführung von Analysen im regionalen/nationalen Rahmen kritisch zu prüfen. “Dazu gehört für uns die Förderung des Aufbaus und der Vernetzung akademischer Datenbanken mit Zugang zu allen molekulardiagnostischen Ergebnissen der Patienten unter Berücksichtigung der nationalen und internationalen Vorgaben des Datenschutzes”, so Wörmann.
Das vollständige Positionspapier der medizinischen Fachgesellschaften kann unter folgender Internetadresse heruntergeladen werden: https://dgho.de/publikationen/stellungnahmen/gute-aerztliche-praxis/molekulare-diagnostik/molekulare-diagnostik-positionspapier-2019-1.pdf
Quelle: Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie e.V. (DGHO)
COMPASS: Wegweiser zu neuen Therapien für krebskranke Kinder

Wenn bei der Behandlung krebskranker Kinder Standardtherapien versagen, können molekulare Verfahren den Weg zu neuen, zielgerichteten Medikamenten weisen. Doch was, wenn diese allein nicht den erhofften Schlüssel zum Behandlungserfolg liefern? “Dann wenden wir Techniken der Hochdurchsatzmikroskopie an, um zu untersuchen, ob das Tumorgewebe auf bestimmte Medikamente anspricht, und erweitern somit die Diagnostik um eine wertvolle Dimension”, so Olaf Witt, Direktor des Translationalen Programmes am KiTZ und Leiter der Klinischen Kooperationseinheit Pädiatrische Onkologie des Deutschen Krebsforschungszentrums und des Universitätsklinikums Heidelberg. “Kombiniert man die funktionalen Bilddaten mit den Informationen, die man durch die molekularen Analysen erhält, so bekommt man genauere Hinweise auf erfolgversprechende Therapieansätze bei bisher unheilbaren Krebserkrankungen im Kindesalter.”
“Ziel ist es, auf der Grundlage der Bildanalysen und begleitender molekularer Analysen eine internationale, standardisierte und validierte Bibliothek für Medikamententests aufzubauen, die verschiedene Tumorarten auf ihr Ansprechen auf unterschiedliche Wirkstoffe hin charakterisiert und eingruppiert”, erklärt KiTZ Mitarbeiterin Sina Oppermann, wissenschaftliche Koordinatorin des COMPASS Projektes. “Diese Daten sollen am KiTZ langfristig in klinischen Studien übersetzt werden, damit betroffene Kinder möglichst schnell von den Erkenntnissen profitieren.”
Genau diesen Ansatz verfolgt das neue Projektes COMPASS (Clinical implementation Of Multidimensional PhenotypicAl drug SenSitivities in paediatric precision oncology), das vom europäischen Konsortium ERA PerMed mit 1,5 Millionen Euro über einen Zeitraum von drei Jahren finanziert wird. ERA PerMed ist ein Zusammenschluss, der sich auf die Förderung von Projekten der personalisierten Medizin konzentriert und sich aus 32 Partnern aus über 23 Ländern zusammensetzt. Er wird von der Europäischen Kommission mitfinanziert. Das Hopp-Kindertumorzentrum Heidelberg (KiTZ) koordiniert das vom europäischen Konsortium ERA PerMed mit 1,5 Millionen Euro geförderte Projekt, an dem neben dem KiTZ wissenschaftliche Einrichtungen aus Frankreich, Holland, Finnland und Ungarn beteiligt sind. Das Hopp-Kindertumorzentrum Heidelberg (KiTZ) ist eine gemeinsame Einrichtung des Deutschen Krebsforschungszentrums (DKFZ), des Universitätsklinikums Heidelberg und der Universität Heidelberg.
Neben dem KiTZ mit seiner europäischen kinderonkologischen Plattform “INFORM” gehören fünf weitere wissenschaftliche Einrichtungen zu den Partnern im COMPASS Projekt: das Institute Curie (Paris, Frankreich), Princess Máxima Center für pädiatrische Onkologie (Utrecht, Niederlande), Akademisch Medizinisches Zentrum der Universität Amsterdam (AMC) (Amsterdam, Niederlande), Institut für Molekulare Medizin Finnland (FIMM) und Universität Helsiniki (Finnland) sowie das Startup Unternehmen Single Cell Technologies Inc. (Szeged, Ungarn).
Quelle: DKFZ – Pressestelle / KiTZ Hopp-Kindertumorzentrum Heidelberg, eine gemeinsame Einrichtung des Deutschen Krebsforschungszentrums (DKFZ), des Universitätsklinikums Heidelberg und der Universität Heidelberg
Darmkrebs: Gut informiert bei sozialrechtlichen Fragen
Für Darmkrebsbetroffene tauchen viele Fragen im Umgang mit ihrer Erkrankung auf, wie beispielsweise:
- Kann ich eine onkologische Rehabilitation beantragen?
- Wie komme ich im Berufsalltag mit meiner Erkrankung klar?
- Wer übernimmt langfristig die Kosten und welche Hilfsangebote stehen mir zu?
Foto: Krebsinformationsdienst, DKFZ
In Kooperation mit der Deutschen ILCO e.V. hat der Krebsinformationsdienst ein Faltblatt erstellt, das die neuesten Informationen zu sozialrechtlichen Themen bietet. Vier Betroffene zwischen 45 und 81 Jahren schildern in dem Flyer „Darmkrebs? Gut informiert bei sozialrechtlichen Fragen“ ihre ganz persönlichen Ängste, Sorgen und Fragen rund um ihr Leben mit Darmkrebs. Der Flyer liefert Orientierung und bietet erste Antworten auf diese und weitere Fragen aus dem Alltag Betroffener. Außerdem nennt er wichtige Ansprechpartner, Anlaufstellen und Adressen und gibt praktische Tipps.
Der Flyer kann im Internet unter folgendem Link abgerufen werden: https://www.ilco.de/darmkrebs/sozialrechtliche-fragen/
Quelle: Krebsinformationsdienst, Deutsches Krebsforschungszentrum (DKFZ)
Innovationen in der Krebsdiagnostik
Fortschritte in der Krebsdiagnostik wurden auch beim Deutschen Krebskongress 2018 in Berlin vorgestellt.
Moderne Bildgebungsverfahren, die nicht nur die anatomische Lage eines Tumors abbilden, sondern auch funktionelle Informationen über den Tumor liefern, bringen deutliche Fortschritte in der Krebsversorgung. Das gilt zum Beispiel für die multiparametrische MRT bei der Diagnose des Prostatakarzinoms. Knapp 70.000 Männer erkranken jährlich daran neu. Die entscheidende Frage in der Primärdiagnostik lautet: Welcher Patient trägt einen rasch wachsenden aggressiven Tumor in sich, der unbedingt behandelt werden muss, und wo kann aufgrund eines niedrigen Risikoprofils zunächst mit der Behandlung abgewartet werden? Die multiparametrische Magnetresonanztomographie (mpMRT) ist das derzeit empfindlichste bildgebende Verfahren, um ein Prostatakarzinom abzubilden. Sie liefert zudem wichtige funktionelle Informationen, etwa über die Durchblutung des Tumors und seine Zelldichte, was wiederum Hinweise auf die individuelle Aggressivität gibt. Eine mpMRT kann damit sowohl anatomische als auch biologische Daten erfassen − die Ergebnisse tragen zu einer besseren Risikoabschätzung bei und ermöglichen eine gezielte Stanzbiopsie. Die mpMRT hat mittlerweile sogar Eingang die aktuelle Leitlinie des Leitlinienprogramms Onkologie gefunden, zum Beispiel, wenn nach einer negativen systematischen Biopsie der Verdacht auf ein Prostatakarzinom weiterbesteht oder wenn ein Patient die aktive Überwachung in Erwägung zieht.
Prof. Dr. Dipl.-Phys. Heinz-Peter Schlemmer, Deutsches Krebsforschungszentrum Heidelberg
Die Grenzen dieser Methode liegen dort, wo die Diagnose mit der MRT nicht hinreichend eindeutig ist: etwa beim Staging, wenn Lymphknotenmetastasen identifiziert werden sollen. Hier ist dieHybridbildgebung gefragt. In der Computertomographie (CT) oder der MRT können befallene Lymphknoten nur dann identifiziert werden, wenn sie eine bestimmte Größe erreicht haben. Bessere Resultate lassen sich in Kombination mit der Positronenemissionstomographie, kurz PET, erzielen. Die PET-MRT-Hybridbildgebung ist ein sehr aussichtsreiches Zukunftsfeld. Die strahlungsfreie MRT zeichnet sich durch einen hohen Weichteilkontrast aus, die Positronenemissionstomographie mit einem geeigneten Radiotracer ist hochempfindlich und kann deshalb selbst kleinste Tumorherde sichtbar machen.
Quelle: Pressemitteilung Deutscher Krebskongress 2018
Bauchspeicheldrüsenkrebs: Gemeinsamer Bundesausschuss G-BA bestätigt Wirksamkeit des Hochintensiven fokussierten Ultraschall (HIFU)
Die Fünf-Jahres-Überlebensrate bei Bauchspeicheldrüsenkrebs beträgt etwa sieben bis acht Prozent. In den meisten Fällen kann der Patient nur noch palliativ behandelt werden. „Bei etwa 80 Prozent der Betroffenen ist die Lebensqualität durch den Tumorschmerz deutlich bis massiv eingeschränkt”, betont Professor Dr. med. Holger Strunk, Oberarzt der Radiologischen Universitätsklinik Bonn. „Im Verlauf der Erkrankung werden diese Schmerzen häufig sogar therapieresistent. Den Patienten hilft dann keine Schmerzmedikation mehr.” Untersuchungen aus Deutschland und dem ostasiatischen Raum zeigen, dass der Einsatz von HIFU in etwa 80 Prozent der Fälle zur Schmerzlinderung bei den Betroffenen führt. „Wir begrüßen daher die G-BA-Entscheidung, dass HIFU bei diesen Patienten eingesetzt werden kann“, so Strunk.
Auch das Tumorvolumen kann durch diese Behandlung bei etwa zwei Drittel der Patienten signifikant verkleinert werden. Experten vermuten, dass HIFU nicht nur einen symptomatischen Nutzen hat, sondern dass diese Methode möglicherweise auch das Überleben positiv beeinflusst. „Hierzu fehlen uns noch weitere klinische Untersuchungen, doch erste Ergebnisse zeigen, dass HIFU ein großes Potential in der Tumorentfernung haben könnte”, erklärt Strunk. Diese Ultraschall-Technik bietet Anwendern und Patienten viele Vorteile: Die Behandlung erfolgt wenig invasiv – und ruft dadurch in der Regel nur geringe Nebenwirkungen hervor. Im Gegensatz zum diagnostischen Ultraschall bündelt der Ultraschallkopf beim HIFU die hochenergetischen Schallwellen wie bei einem Hohlspiegel in einem Brennpunkt innerhalb des menschlichen Körpers. Durch die Absorption der Ultraschallwellen entsteht Wärme, die das Gewebe im Fokus des HIFU auf bis zu 80 Grad erhitzt. Bei diesen Temperaturen gerinnt das Eiweiß und die Zellen des Tumors sterben ab.
„Ein weiterer großer Vorteil ist, dass sehr präzise gearbeitet werden kann und auch Tumore in der Nähe von Blutgefäßen behandelt werden können“, ergänzt Strunk. „Da keine Nadeln, Sonden oder ähnliches eingebracht werden müssen, besteht zudem keine Gefahr einer Blutung oder der Tumorzellverschleppung, wie sie bei anderen Verfahren durch den Stichkanal vorkommen kann.“ Der G-BA hat auch überprüft, ob Studien vorliegen, die den Stellenwert des HIFU bei anderen Erkrankungen belegen. Da dies aber ein relativ neues Verfahren ist, gibt es jedoch bisher nur zu wenigen Krankheitsbildern Studien, wie eben zum Pankreaskarzinom, dem Leberzellkarzinom und dem Gebärmuttermyom. Nichtsdestotrotz könnten zukünftige Untersuchungen auch hier weitere Indikationen aufzeigen. Auf völliges Unverständnis seitens der DEGUM stößt daher die Ablehnung des G-BA, den Stellenwert des HIFU bei anderen Indikationen wie Leber-, Knochenmark- und Knochentumoren oder der Endometriose, einer gutartigen Wucherung von Gewebe der Gebärmutterschleimhaut, durch Studien zu evaluieren.
„Mag ja sein, dass zukünftige Studien aufzeigen, dass es hier für den HIFU keinen Stellenwert gibt. Doch viele Patienten mit diesen Erkrankungen profitieren nachweislich von einem Einsatz des HIFU. Gerade bei der palliativen Behandlung von Knochenmetastasen am peripheren Skelett könnte HIFU zunehmend an Bedeutung gewonnen”, erklärt Strunk. „Nur weil derzeit keine deutschen Studien vorliegen, kann man doch nicht a priori weitere Studien ausschließen. Was ist das für ein Verständnis von Wissenschaft. Hier müssten unbedingt weitere klinische Studien zur Untersuchung des langfristigen Nutzens dieser Methode erfolgen”, so der DEGUM-Experte.
Litera:turhinweise:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5376281/
Quelle: Deutsche Gesellschaft für Ultraschall in der Medizin (DEGUM) - www.degum.de
Bewegungstherapie hocheffektiv
Neue Erkenntnisse zu Fatigue und Polyneuropathie beim 33. Deutschen Krebskongress 2018 in Berlin vorgestellt.
Viele Krebspatienten leiden unter den Nebenwirkungen ihrer Therapie. Dazu gehören etwa Erschöpfung, auch Fatigue-Syndrom genannt, oder Polyneuropathie, eine Schädigung der Nerven. Gezieltes bewegungstherapeutisches Training hilft, die zum Teil starken Einschränkungen zu reduzieren und die Lebensqualität der Betroffenen zu steigern. Aktuelle Studienergebnisse – unter anderem eine Meta -Analyse aus den USA – konnten nun belegen: Körperliche Aktivität vermindert die Beschwerden erfolgreicher als eine medizinische oder eine psychologische Therapie.
„Bewegung ist das geeignetste ‚Medikament‘ zur Reduzierung des Fatigue-Syndroms“, berichtete PD Dr. Freerk Baumann, Leiter der Arbeitsgruppe Onkologische Bewegungsmedizin am CIO Köln/Bonn. Doch nicht nur bei der Behandlung des Fatigue-Syndroms gibt es neue Erkenntnisse. „Auch bei der Chemotherapie-induzierten Polyneuropathie (CIPN) zeigen Studien, dass Bewegungstherapie hilft. Für die Polyneuropathie gibt es keine andere Behandlungsmethode, deren nachhaltige Wirkung bewiesen werden konnte“, so Baumann weiter. „Sensomotorisches Training und womöglich auch Vibrationstraining erzielen die besten Effekte bei der Therapie von Nervenschäden, wie eingeschränktes Tastgefühl an den Händen sowie Kribbeln und Schmerzen an Händen und Füßen.“ Dieser Ansatz wird derzeit in einer gemeinsamen Studie der Deutschen Sporthochschule Köln und der Uniklinik Köln weiter verfolgt. Erste Forschungsergebnisse unterstützen die Annahme, dass spezielles Bewegungstraining eine hemmende Wirkung auf die CIPN haben könnte.
Trotz der Erfolge, die mit einer gezielten Bewegungstherapie erreicht werden können, ist es jedoch schwierig, entsprechende Versorgungsstrukturen für alle Patienten zu schaffen. „Ein therapeutisches Training während der medizinischen Krebstherapie muss individuell auf die Patienten angepasst werden. Hierzu bedarf es speziell ausgebildeter Sport- und Physiotherapeuten, von denen es zurzeit noch nicht genügend gibt“, erklärte der Direktor des Centrums für integrierte Onkologie (CIO) Köln/Bonn, Professor Dr. Michael Hallek. „Darüber hinaus bestehen in den Onkologischen Zentren auch räumliche und finanzielle Engpässe, um hochwertige Trainingsgeräte anzuschaffen.“ Erschwerend käme hinzu, dass die Sporttherapie im Gegensatz zur Physiotherapie nicht im Heilmittelkatalog aufgeführt ist , obwohl die positiven Effekte durch Sporttherapie bereits sehr gut wissenschaftlich belegt seien.
„Hier ist die Gesundheitspolitik gefordert, dies schnellstens zu ändern“, unterstrich PD Dr. Baumann. „Denn, würde die Sporttherapie in den Heilmittelkatalog aufgenommen, so wäre es für die Krebszentren deutlich einfacher, entsprechende bewegungstherapeutische Strukturen aufzubauen.“ Um umfassende Informationen über die Versorgungsstrukturen zur Bewegungstherapie in Deutschland zu erhalten und Erkenntnisse darüber zu gewinnen, inwieweit Krebspatienten die Möglichkeiten der Sporttherapie überhaupt vermittelt werden, hat die Deutsche Krebshilfe eine bundesweite Umfrage bei über 700 Krebszentren durchgeführt. „Die Ergebnisse dieser Befragung werden in Kürze vorliegen, doch schon jetzt zeichnet sich dringender Handlungsbedarf ab“, erklärte Gerd Nettekoven, Vorstandsvorsitzender der Deutschen Krebshilfe.
„Das Thema körperliche Aktivität in der Krebstherapie hat für die Deutsche Krebshilfe einen hohen Stellenwert. Wir halten es für wichtig, die Forschung auf diesem Gebiet voranzutreiben, um weitere wissenschaftliche Erkenntnisse zu erhalten. Wir wollen aber auch Krebspatienten und Ärzte umfassend über die positiven Effekte der Bewegungstherapie informieren.
“ Dies gelte zudem nicht nur für die Zeit während der Therapie, sondern auch für die Zeit danach, denn auch in der Krebsnachsorge seien Sport und Bewegung wichtig für das Wohlbefinden der Betroffenen. Um das Thema Bewegung stärker und mit Nachhaltigkeit sowohl in der Therapie als auch in der Krebsnachsorge zu verankern, haben die Deutsche Krebshilfe, der Deutsche Olympische Sportbund und die Deutsche Sporthochschule Köln im Jahr 2014 die Initiative „Bewegung gegen Krebs“ gestartet.
Unterstützt werden sie dabei von Heiko Herrlich, ehemaliger Fußballprofi und heute Bundesligatrainer sowie Antje Möldner-Schmidt, Europameisterin im 3.000-Meter-Hindernislauf. Herrlich und Möldner-Schmidt wissen als ehemalige Patienten um die zentrale Bedeutung von Sport und Bewegung während und nach der Krebstherapie. „Für mich brach eine Welt zusammen, als ich mit der Diagnose Krebs konfrontiert wurde“, berichtete Möldner-Schmidt in Berlin. „Doch Sport und Bewegung haben mir sehr geholfen, die schwere Zeit durchzustehen und viele Hürden zu überwinden.“ Die Leichtathletin erkrankte im Januar 2010 an Morbus Hodgkin. Bereits zehn Monate nach der Diagnose nahm sie das Training wieder auf und wurde im Jahr 2014 Europameisterin.
Quelle: Presseinformation 33. Deutscher Krebskongress 2018, Pressestelle Deutsche Krebsgesellschaft und Pressestelle Stiftung Deutsche Krebshilfe e.V.
Hirntumor-Informationstag am 21. April 2018 in Würzburg
Am 21. April 2018 veranstaltet die Deutsche Hirntumorhilfe zum nunmehr 42. Mal den bundesweiten Hirntumor Informationstag unter dem Thema „Fortschritte in der Therapie von Hirntumoren“ und lädt interessierte Patienten, Angehörige und Ärzte diesmal nach Würzburg ein. Mit mehr als 400 erwarteten Teilnehmern ist die ganztägige Informationsveranstaltung einzigartig im deutschsprachigen Raum. Die Teilnehmer erwartet ein vielfältiges Vortragsprogramm mit hochkarätigen Referenten.
 Foto: Dt. Hirntumorhilfe e.V.
Foto: Dt. Hirntumorhilfe e.V.
Deutschlandweit erkranken jährlich über 7.000 Menschen neu an einem primären bösartigen Hirntumor, die Zahl der Patienten mit Hirnmetastasen infolge von Lungenkrebs, Brustkrebs oder anderen Krebsleiden ist ungleich höher. Die Deutsche Hirntumorhilfe hat sich seit 20 Jahren als zentrale Anlauf- und Kontaktstelle für Betroffene etabliert. Mit dem Hirntumor-Informationstag bietet die gemeinnützige Organisation zweimal im Jahr ein gemeinsames Forum zum Austausch für Betroffene, Experten und Multiplikatoren. Alle Projekte und Aktivitäten des unabhängigen Vereins werden ausschließlich durch private Spenden und Zuwendungen finanziert.
Erfahrene Mediziner und anerkannte Wissenschaftler aus dem Bereich Neuroonkologie geben einen aktuellen Überblick zu Standards und Innovationen in der Therapie von Hirntumoren und Hirnmetastasen. Bei Podiumsdiskussionen und persönlichen Gesprächen mit den Referenten haben die Teilnehmer der Veranstaltung zudem die Möglichkeit, individuelle Fragen zu klären. Darüber hinaus wird mit dem Symposium Patienten und Angehörigen eine Plattform geboten, mit anderen Betroffenen in Kontakt zu treten, Tipps zum Umgang und zur besseren Bewältigung der Erkrankung auszutauschen sowie eigene Erfahrungen zu teilen.
42. Hirntumor-Informationstag in Würzburg Veranstaltungstermin: Samstag, 21.04.2018, 9:30-18:30 Uhr, Einlass ab 8:30 Uhr Veranstaltungsort: Julius-Maximilians-Universität Zentrales Hörsaal- und Seminargebäude (Z6), Hörsaal 0.004, Am Hubland, 97074 Würzburg Weitere Informationen, Anmeldung und Programm: Deutsche Hirntumorhilfe e.V. Telefon: 0341.590 93 96 info@hirntumorhilfe.de www.hirntumorhilfe.de/projekte/informationstag
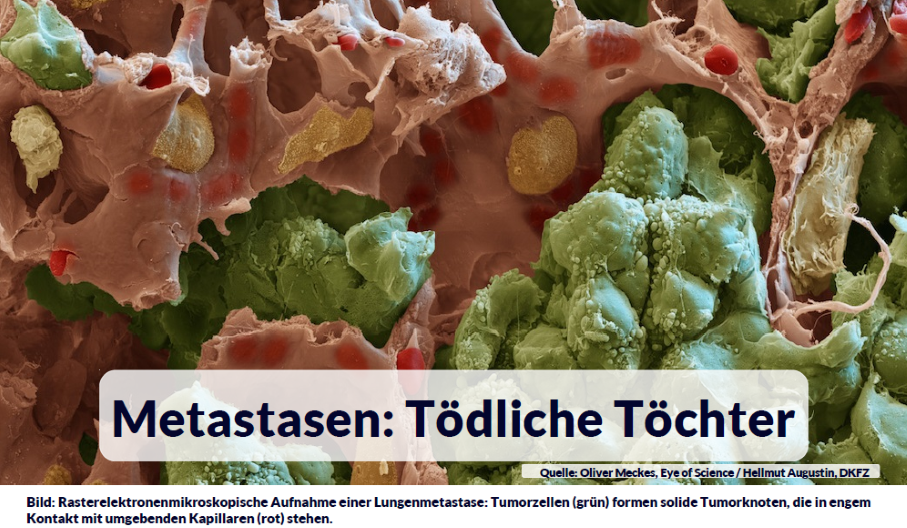
Metastasen: die tödlichen Töchter
Cirka 90 Prozent aller Krebstodesfälle gehen auf das Konto von Metastasen, wie Mediziner die Absiedlungen bösartiger Tumoren nennen. Hat sich der Krebs erst im Körper verbreitet, ist er in der Regel nicht mehr heilbar. Zum Weltkrebstag 2018 informierten Experten aus dem Deutschen Krebsforschungszentrum, wie es zu dieser Ausbreitung kommt: Tumorzellen zweckentfremden Blutbahnen, sabotieren ihre Umgebung und tarnen sich als “Schläfer”. Aber die Wissenschaftler haben Ideen, wie sich dieser lebensbedrohliche Prozess möglicherweise aufhalten lässt. Was macht Krebserkrankungen so gefährlich? 90 Prozent aller Krebstodesfälle gehen auf das Konto von Tumorabsiedlungen, schätzt die Weltgesundheitsorganisation WHO. Krebszellen, die sich vom Primärtumor absondern, gelangen in entfernte Körperregionen und wachsen dort zu Tochtergeschwülsten, Metastasen, heran. “Während sich viele Primärtumoren vor allem in frühen Stadien heute gut behandeln lassen, sind Metastasen die eigentliche und letztlich tödliche Gefahr”, erklärt Susanne Weg-Remers, die Leiterin des Krebsinformationsdienstes des Deutschen Krebsforschungszentrums (DKFZ). “Leider kommt es immer wieder vor, dass ein Tumor nach zunächst erfolgreicher Behandlung wiederkehrt. Wenn dann der Krebs bereits gestreut hat, sinken die Erfolgsaussichten einer Therapie rapide. Neue Medikamente, die das Rückfallrisiko senken können, sind daher ein zentrales Anliegen der Krebsforschung.” Forscher schätzen, dass sich von einem Tumor in der Größe eines Kubikzentimeters täglich etwa eine Million Zellen ablösen können – aber nur ein verschwindend kleiner Prozentsatz davon wächst tatsächlich zu einer Tochtergeschwulst heran. “Die Metastasierung ist im Grunde genommen extrem ineffizient: Es müssen sehr viele Voraussetzungen zusammenkommen, dass es dem Tumor gelingt, sich auszubreiten. Trotz der immensen medizinischen Bedeutung der Metastasierung ist dieser Prozess leider noch sehr wenig verstanden”, sagt Hellmut Augustin vom DKFZ und von der Medizinischen Fakultät Mannheim der Universität Heidelberg. Heute ist unbestritten, dass sich Krebszellen – anders als früher vermutet – auch schon von kleinsten Tumoren ablösen können. Um sich nun im Körper zu verbreiten, ist ein Transportsystem erforderlich – und das organisiert sich der Tumor selbst: Von einem Durchmesser von etwa einem Millimeter an ist jede Krebsgeschwulst auf die Versorgung durch Blut- oder Lymphgefäße angewiesen. Die lockt sie aktiv mit Wachstumsfaktoren herbei – und zweckentfremdet sie als Fernstraßen, um Lunge, Leber oder das Gehirn zu erreichen. Tumorzellen und Blutgefäße: eine intime Beziehung Die Reise über die Blutbahnen ist für eine Krebszelle beschwerlich: Sie muss sich zunächst durch die Zellen der Gefäßwand zwängen. In der Blutbahn selbst ist die starke Strömung eine immense Herausforderung. Um das Gefäßinnere wieder zu verlassen, braucht die Krebszelle geeignete Proteine zum Andocken und Überwinden der Gefäßbarriere. “Das ist ein extrem aktiver Prozess, der auf zahlreichen Wechselwirkungen zwischen der Krebszelle und den Gefäßwandzellen beruht”, sagt Andreas Fischer vom DKFZ. Der Gefäßexperte, der auch an der Medizinischen Fakultät Mannheim der Universität Heidelberg forscht, erkannte vor kurzem, dass Krebszellen die Blutgefäße für ihre eigenen Zwecke umprogrammieren: Sie veranlassen die Gefäßwandzellen, ihnen leichter Durchlass zu gewähren. Zugleich bilden die Gefäßwandzellen bestimmte Proteine aus, an denen sich die Krebszelle wie mit einem Druckknopf verankern und die Blutbahn wieder verlassen kann. Fischers Team konnte die molekularen Schalter, die an dieser Sabotage beteiligt sind, identifizieren und teilweise mit Antikörpern blockieren: Daraufhin entwickelten krebskranke Mäuse weniger Lungenmetastasen. Wegen der immensen Bedeutung der Blutgefäße für Wachstum und Ausbreitung der Tumoren ist die Gefäßneubildung seit Jahrzehnten schon im Visier der Krebsforscher. Das erste Medikament, das diesen Vorgang blockiert, kam bereits 2005 auf den Markt – erzielte aber nur mäßige klinische Erfolge. Hellmut Augustin versucht daher, auf andere Weise zu verhindern, dass sich der Tumor mit neuen Adern versorgt. Dazu erforscht er systematisch die Signalmoleküle der Gefäßwandzellen – und entdeckte kürzlich den Rezeptor Tie1 als mögliches neues Therapieziel: Krebskranke Mäuse, in deren Gefäßwandzellen Tie1 genetisch ausgeschaltet war, entwickelten deutlich langsamer und deutlich weniger Metastasen – im Gegensatz zu ihren genetisch normalen Artgenossen. “Sicherlich müssen mehrere Schlüsselmoleküle zugleich blockiert werden, um die Gefäßneubildung wirklich effizient zu unterdrücken”, so der DKFZ-Forscher. “Ein Wirkstoff, der den Rezeptor Tie1 inaktiviert, ließe sich sinnvoll mit anderen antiangiogenen Medikamenten kombinieren.” Fruchtbarer Boden für Metastasen Metastasen treten nicht nach dem Zufallsprinzip im Körper auf, sondern – je nach Tumorart – bevorzugt in bestimmten Organen. So siedelt Prostatakrebs besonders häufig in die Wirbelsäule ab, Melanome in das Gehirn. Woran das liegt, ist nur teilweise bekannt. Allein an der Blutmenge, die ein Organ durchströmt, kann es nicht liegen, sonst müsste es beispielsweise viel mehr Metastasen in den Nieren geben – was aber tatsächlich sehr selten vorkommt. Bereits 1889 veröffentlichte der britische Chirurg Stephen Paget dazu eine berühmte Theorie: “Seed and Soil”, zu Deutsch etwa Saatkorn und Boden, müssten bei der Metastasierung zusammenwirken, so der Forscher. Bestimmte Gewebe böten bestimmten Krebszellen einen “fruchtbaren Boden”, beispielsweise in Form von Wachstumsfaktoren oder Molekülen, an die Krebszellen andocken und sich festsetzten können. “Schläfer” im Gehirn ausschalten Besonders viele Rätsel gibt die Entstehung von Hirnmetastasen auf. Insbesondere Melanome, Brust- und Lungenkrebs siedeln sich im Gehirn an: “Obwohl es für Krebszellen gar nicht so einfach ist, dort hinzukommen”, sagt Frank Winkler, der am DKFZ und am Universitätsklinikum Heidelberg erforscht, wie Hirnmetastasen entstehen. Winkler hatte im Gehirn von Mäusen das Verhalten einzelner Tumorzellen beobachtet und dabei ein typisches Verhaltensmuster festgestellt: Nach dem Austritt aus der Blutbahn heftet sich die Krebszelle an die Außenseite feiner Kapillargefäße und schart dort bestimmte Gehirnzellen um sich. In dieser “Gefäß-Nische” nehmen Hirnmetastasen grundsätzlich ihren Anfang. Die Frage ist nur, wann: Manchmal bleibt die Krebszelle einfach in ihrer Nische liegen, ohne zu wachsen. “Es ist ein großes medizinisches Problem, dass Metastasen oft erst viele Jahre nach einer scheinbar erfolgreichen Krebsbehandlung auftreten. “Wir wollen unbedingt herausfinden, wie diese “Schläfer” es schaffen, zu einer lebensgefährlichen Hirnmetastase heranzuwachsen”, so der Neurologe. Damit befasst sich das von der Deutschen Krebshilfe finanzierte Verbundprojekt “Präventive Strategien gegen Hirntumoren”, das Winkler leitet. “Wir haben bereits wichtige Prozesse der Gehirnmetastasierung aufgeschlüsselt und nehmen gezielt solche Interaktionen zwischen Tumorzelle und Gehirn ins Visier, die wir mit heute schon verfügbaren Medikamenten beeinflussen können.” In spätestens drei Jahren wollen die Forscher genug Erkenntnisse gesammelt haben, um eine klinische Studie zu starten. Das Ziel ist, mit dem aussichtsreichsten Wirkstoff zukünftige Gehirnmetastasen zu verhindern. “Metastasen sind auch deswegen schwer zu behandeln, weil sie sich häufig stark von den Krebszellen des Ursprungstumors unterscheiden”, erklärt Susanne Weg-Remers. “Neue Medikamente, die verhindern, dass Tumoren sich überhaupt auf diese Weise ausbreiten, könnten die Krebstherapie bedeutend verbessern. Bis dahin ist es umso wichtiger, dass Krebs früh erkannt wird, bevor der Tumor gestreut hat. Rechtzeitig behandelt, gibt es heute bei vielen Krebsarten eine gute Chance auf Heilung.”
Quelle: DKFZ -Deutsches Krebsforschungszentrum, Heidelberg Der Krebsinformationsdienst des Deutschen Krebsforschungszentrums: Telefon: 0800 420 30 40 (kostenfrei, täglich von 8.00 – 20.00) E-Mail: krebsinformationsdienst@dkfz.de www.krebsinformationsdienst.deAML (Akute myeloische Leukämie) – Neues Medikament verlängert deutlich Überlebenszeit
Ein internationales Konsortium hat unter deutscher Beteiligung – unter anderem mit Wissenschaftlern von der Medizinischen Hochschule Hannover (MHH) – erfolgreich eine neue Therapie zur Behandlung der Akuten myeloischen Leukämie (AML) entwickelt. Mit dem Einsatz des Medikaments Midostaurin zusätzlich zur standardgemäßen Behandlung kann das durchschnittliche Gesamtüberleben von AML-Patienten mit einer speziellen Genmutation – des FLT3-Gens – von 25,6 Monaten auf 74,7 Monate verlängert werden. Von der MHH sind Professor Dr. Arnold Ganser und Professor Dr. Jürgen Krauter (Chefarzt der Klinik f. Hämatologie und Onkologie am Klinikum Braunschweig) Koautoren. “Die Studie ist deshalb so wichtig, weil sie nach vielen Jahrzehnten erstmals wieder zu einer Neuzulassung eines Medikamentes für jüngere Patienten mit AML geführt hat”, sagt Professor Ganser, Direktor der Klinik für Hämatologie, Hämostaseologie, Onkologie und Stammzelltransplantation. Dieses Medikament wird für jeden dritten Patienten mit AML den Behandlungserfolg deutlich verbessern. Die Ergebnisse sind in der Online-Ausgabe der renommierten Fachzeitschrift New England Journal of Medicine veröffentlicht (June 23, 2017; DOI: 10.1056/NEJMoa1614359). Midostaurin ist kein Chemotherapeutikum, sondern gehört zur Gruppe der molekular wirkenden Medikamente, die gezielt genetische Veränderungen in den Tumorzellen ausnutzen. Es ist vom Bakterium Streptomyces staurosporeus abgeleitet, das die Teilung der leukämischen Zellen verhindert, indem es die Weiterleitung von Signalen, unter anderem des Wachstumsfaktors FLT3 aber auch anderer Kinasen, blockiert. Um Midostaurin einsetzen zu können, müssen die Leukämiezellen bestimmte Mutationen in einem ganz bestimmten Gen, dem FLT3-Gen, aufweisen. Dies wird vor Beginn der Therapie getestet. “Bei etwa einem Drittel der AML-Patienten lassen sich diese spezifischen FLT3-Mutationen nachweisen und gezielt für die Therapie ausnutzen”, erklärt Professor Ganser. “An der MHH besteht eines der weltweit acht Labore, in denen im Rahmen der Studie Patientenzellen auf diese genetischen Veränderungen geprüft wurden.” Dazu werden im Hämatologisch-molekulargenetischen Labor der MHH-Klinik von Professor Ganser unter der Leitung von Professor Dr. Michael Heuser und Privatdozentin Dr. Felicitas Thol die Tumorzellen auf eine Vielzahl von Mutationen (Veränderungen) getestet, um die jeweils beste Therapie zu identifizieren.
 Prof. Dr. Arnold Ganser (links) im Gespräch mit Privatdozentin Felicitas Thol und Prof. Dr. Michael Heuser
Prof. Dr. Arnold Ganser (links) im Gespräch mit Privatdozentin Felicitas Thol und Prof. Dr. Michael Heuser
Die Amerikanische Zulassungsbehörde FDA hat Ende April Midostaurin in Kombination mit der herkömmlichen Chemotherapie zur Behandlung der AML zugelassen, die Schweiz wenige Tage später. Die Zulassung für die übrigen europäischen Länder durch die EMA (European Medicines Agency) wird wohl noch in diesem Jahr erfolgen. “Für uns bedeutet es einen großen Erfolg in der klinischen Forschung zum Wohle der Patienten”, betont Professor Ganser.
Quelle: MHH Medizinische Hochschule Hannover vom 4. Juli 2017
Abstract der Studiendaten im “The NEW ENGLAND JOURNAL of MEDICINE” - http://www.nejm.org/doi/full/10.1056/NEJMoa1614359#t=abstract